
 N2(g
N2(g )��O2(g)
)��O2(g) 2NO(g) ��H��a kJ��mol-1��ƽ�ⳣ��K���±���
2NO(g) ��H��a kJ��mol-1��ƽ�ⳣ��K���±���| �¶�/�� | 1538 | 1760 | 2404 |
| ƽ�ⳣ��K | 0��86��10��4 | 2��6��10��4 | 64��10��4 |
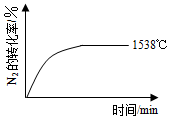
 ��ʽ���£�
��ʽ���£� (g)��3O2(g) ��H����1530kJ��mol-1
(g)��3O2(g) ��H����1530kJ��mol-1 �о����ø����ӵ����Ե�SCY�մɣ��ܴ���H+��ʵ�ֵ��Ĺ̶��������ĵ�ⷨ�ϳɣ��������˵�����������ת���ʡ��ܷ�ӦʽΪ��N2��3H2
�о����ø����ӵ����Ե�SCY�մɣ��ܴ���H+��ʵ�ֵ��Ĺ̶��������ĵ�ⷨ�ϳɣ��������˵�����������ת���ʡ��ܷ�ӦʽΪ��N2��3H2 2NH3�����ڵ�ⷨ�ϳɰ��Ĺ����У�Ӧ����2���ϵ�ͨ�� ������������������� ������ ��������������һ�缫ͨ��N2���õ缫��ӦʽΪ ��
2NH3�����ڵ�ⷨ�ϳɰ��Ĺ����У�Ӧ����2���ϵ�ͨ�� ������������������� ������ ��������������һ�缫ͨ��N2���õ缫��ӦʽΪ ��
 ��4���ϳɰ��ķ�ӦN2(g)+3H2(g)
��4���ϳɰ��ķ�ӦN2(g)+3H2(g)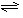 2NH3(g) ��H = ��92��4 kJ��mol��1��һ�������µ��ܱ������У��÷�Ӧ�ﵽƽ�⣬Ҫ���N2��ת���ʣ����Բ�ȡ�Ĵ�ʩ��__________������ĸ���ţ���
2NH3(g) ��H = ��92��4 kJ��mol��1��һ�������µ��ܱ������У��÷�Ӧ�ﵽƽ�⣬Ҫ���N2��ת���ʣ����Բ�ȡ�Ĵ�ʩ��__________������ĸ���ţ��� ��5����25���£���a mol��L-1�İ�ˮ��0��01 mol��L-1������������ϣ���Ӧ����Һ��c(NH4+)=c(Cl-)������Һ��_____________�ԣ���ᡱ������С��������ƶ�a 0��01������ڡ����ڻ�С�ڣ���
��5����25���£���a mol��L-1�İ�ˮ��0��01 mol��L-1������������ϣ���Ӧ����Һ��c(NH4+)=c(Cl-)������Һ��_____________�ԣ���ᡱ������С��������ƶ�a 0��01������ڡ����ڻ�С�ڣ��� ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 H2(g) + CO2(g)��ƽ�ⳣ�����¶ȵı仯���±���
H2(g) + CO2(g)��ƽ�ⳣ�����¶ȵı仯���±���| �¶�/�� | 400 | 500 | 850 |
| ƽ�ⳣ�� | 9.94 | 9 | 1 |
| ʱ �䣨min�� | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
 1/2N2O4(g) ��H = ��26.35 kJ��mol��1
1/2N2O4(g) ��H = ��26.35 kJ��mol��1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 H2(g)��CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���
H2(g)��CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���| �¶�/�� | 400 | 500 | 830 |
| ƽ�ⳣ��K | 10 | 9 | 1 |
| ʵ���� | ��Ӧ��Ͷ���� | ƽ��ʱH2Ũ�� | ���ջ�ų������� | ��Ӧ��ת���� |
| A | 1��1��0��0 | c1 | Q1 | ��1[��Դ:] |
| B | 0��0��2��2 | c2 | Q2 | ��2 |
| C | 2��2��0��0 | c3 | Q3 | ��3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 +SO2
+SO2 +H2O���и���ʵ������Һ���ȱ���ǵ���
+H2O���и���ʵ������Һ���ȱ���ǵ��� | ��� | | �μӷ�Ӧ������ | ||||
| ��Ӧ�¶�(��) |  |  |  | |||
| V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | ||
| A | 10 | 5 | 0��1 | 5 | 0��1 | 5 |
| B | 10 | 5 | 0��1 | 5 | 0��1 | 10 |
| C | 30 | 5 | 0��2 | 5 | 0��2 | 5 |
| D | 30 | 5 | 0��2 | 5 | 0��2 | 10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���÷�Ӧ��ֵ�������Է����� |
| B�����������Է����� |
| C�������²����Է��仯�����������Է��仯 |
| D���κ��¶��¶������Է��仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��
�� 2CA3(g)������Ӧ�ﵽƽ��ʱ���ϸı�����(���ı�A2��C2��CA3����)����ͼ
2CA3(g)������Ӧ�ﵽƽ��ʱ���ϸı�����(���ı�A2��C2��CA3����)����ͼ ��ʾ��Ӧ�����뷴Ӧ���̵Ĺ�ϵ�����б�ʾƽ��������CA3�ĺ�����ߵ�һ��ʱ���� ���¶�ΪT��ʱ����4amolA2��2a molC2����1L�ܱ������У���ַ�Ӧ����C2��ת����Ϊ50������ƽ��������C2���������Ϊ ��ƽ��ʱѹǿΪ��ʼѹǿ�� ����
��ʾ��Ӧ�����뷴Ӧ���̵Ĺ�ϵ�����б�ʾƽ��������CA3�ĺ�����ߵ�һ��ʱ���� ���¶�ΪT��ʱ����4amolA2��2a molC2����1L�ܱ������У���ַ�Ӧ����C2��ת����Ϊ50������ƽ��������C2���������Ϊ ��ƽ��ʱѹǿΪ��ʼѹǿ�� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 NO��g��+6H2O��g�� ��H=-bkJ/mol
NO��g��+6H2O��g�� ��H=-bkJ/mol ��N2��g��+3H2��g�� 2NH3��g���ġ�H= ��
��N2��g��+3H2��g�� 2NH3��g���ġ�H= ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ڸ����Ϸ���������Ӧ |
| B����ѧ���ʽϻ��õĽ���Ϊ���� |
| C�������·�ϵ����ɸ����������� |
| D�����ɵ���ת��Ϊ��ѧ�ܵ�װ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѧ��Ӧ����v |
| B��������ʵĵ���ƽ�ⳣ��Ka |
| C����ѧƽ�ⳣ��K |
| D��ˮ�����ӻ�����KW |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com