
ЁОЬтФПЁПМзДМЪЧвЛжжПЩдйЩњЕФЧхНрФмдДЃЌОпгаЙуРЋЕФПЊЗЂКЭгІгУЧАОАЁЃ
ЃЈ1ЃЉвбжЊ ЂйCH3OH(g)+H2O(l)=CO2(g)+3H2(g) ІЄH= + 93.0kJЁЄmolЃ1
ЂкCH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ІЄH=Ѓ192.9 kJЁЄmolЃ1
O2(g)=CO2(g)+2H2(g) ІЄH=Ѓ192.9 kJЁЄmolЃ1
ЂлМзДМЕФШМЩеШШЮЊ726.51kJЁЄmol-1ЁЃ
вЊаДГіБэЪОМзДМШМЩеШШЕФШШЛЏбЇЗНГЬЪНЃЌЛЙШБЩйЕФШШЛЏбЇЗНГЬЪНЮЊ________________ЁЃ
ЃЈ2ЃЉМзДМПЩВЩгУУКЕФЦјЛЏЁЂвКЛЏжЦШЁ(CO+2H2CH3OH ІЄH<0)ЁЃдкT1ЁцЪБЃЌЬхЛ§ЮЊ2LЕФКуШнШнЦїжаГфШыЮяжЪЕФСПжЎКЭЮЊ3molЕФH2КЭCOЃЌЗДгІДяЕНЦНКтЪБCH3OHЕФЬхЛ§ЗжЪ§(V%)гы![]() ЕФЙиЯЕШчЭМЫљЪОЁЃ
ЕФЙиЯЕШчЭМЫљЪОЁЃ
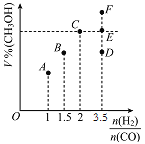
ЂйЕБЦ№ЪМ![]() =2ЃЌОЙ§5minДяЕНЦНКтЃЌ0~5minФкЦНОљЗДгІЫйТЪv(H2)=0.1molL-1min-1ЃЌдђИУЬѕМўCOЕФЦНКтзЊЛЏТЪЮЊ_____ЃЛШєЦфЫќЬѕМўВЛБфЃЌдкT2Ёц(T2>T1)ЯТДяЕНЦНКтЪБCOЕФЬхЛ§ЗжЪ§ПЩФмЪЧ____(ЬюБъКХ)
=2ЃЌОЙ§5minДяЕНЦНКтЃЌ0~5minФкЦНОљЗДгІЫйТЪv(H2)=0.1molL-1min-1ЃЌдђИУЬѕМўCOЕФЦНКтзЊЛЏТЪЮЊ_____ЃЛШєЦфЫќЬѕМўВЛБфЃЌдкT2Ёц(T2>T1)ЯТДяЕНЦНКтЪБCOЕФЬхЛ§ЗжЪ§ПЩФмЪЧ____(ЬюБъКХ)
A.<![]() B.=
B.=![]() C.
C.![]() ~
~ ![]() D.=
D.=![]() E.>
E.> ![]()
ЂкЕБ![]() =3.5ЪБЃЌДяЕНЦНКтзДЬЌКѓЃЌCH3OHЕФЬхЛ§ЗжЪ§ПЩФмЪЧЭМЯѓжаЕФ____ЕубЁЬюЁАDЁБЁЂЁАEЁБЛђЁАFЁБ)ЁЃ
=3.5ЪБЃЌДяЕНЦНКтзДЬЌКѓЃЌCH3OHЕФЬхЛ§ЗжЪ§ПЩФмЪЧЭМЯѓжаЕФ____ЕубЁЬюЁАDЁБЁЂЁАEЁБЛђЁАFЁБ)ЁЃ
ЃЈ3ЃЉжЦМзДМЕФCOКЭH2ПЩгУЬьШЛЦјРДжЦШЁЃКCO2(g)+CH4(g)2CO(g)+2H2(g)ЁЃдкФГвЛУмБеШнЦїжагаХЈЖШОљЮЊ0.1molЁЄL1ЕФCH4КЭCO2ЃЌдквЛЖЈЬѕМўЯТЗДгІЃЌВтЕУCH4ЕФЦНКтзЊЛЏТЪгыЮТЖШМАбЙЧПЕФЙиЯЕШчЭМЫљЪОЃЌдђИУЗДгІЕФІЄH______(бЁЬюЁАДѓгкЁБЁАаЁгкЁБЛђЁАЕШгкЁБЃЉ0ЁЃбЙЧПp1_______(бЁЬюЁАДѓгкЁБЛђЁАаЁгкЁБ)p2ЁЃЕБбЙЧПЮЊp2ЪБЃЌдкyЕуЃКv(е§)__________(бЁЬюЁАДѓгкЁБЁАаЁгкЁБЛђЁАЕШгкЁБ)v(Фц)ЁЃШєp2=6MpaЃЌдђTЁцЪБИУЗДгІЕФЦНКтГЃЪ§Kp=_____MPa2ЃЈгУЦНКтЗжбЙДњЬцЦНКтХЈЖШМЦЫуЃЌЗжбЙ=змбЙЁСЮяжЪЕФСПЗжЪ§ЃЉЁЃ
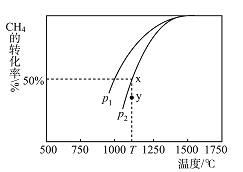
ЃЈ4ЃЉбаОПБэУїЃКCO2КЭH2дквЛЖЈЬѕМўЯТвВПЩвдКЯГЩМзДМЃЌЗДгІЗНГЬЪНЮЊCO2(g)+3H2(g)CH3OH(g)+H2O(g) [ЗДгІЂё]ЁЃ
ЂйвЛЖЈЬѕМўЯТЃЌЭљ2LКуШнУмБеШнЦїжаГфШы2.0mol CO2КЭ4.0mol H2ЃЌдкВЛЭЌДпЛЏМСзїгУЯТКЯГЩМзДМЃЌЯрЭЌЪБМфФкCO2ЕФзЊЛЏТЪЫцЮТЖШБфЛЏШчЯТЭМЫљЪОЃЌЦфжаЛюЛЏФмзюИпЕФЗДгІЫљгУЕФДпЛЏМСЪЧ____(ЬюЁАAЁБЁЂЁАBЁБЛђЁАCЁБ)ЁЃ

ЂкдкФГДпЛЏМСзїгУЯТЃЌCO2КЭH2Г§ЗЂЩњЗДгІЂйЭтЃЌЛЙЗЂЩњШчЯТЗДгІCO2(g)+H2(g)CO(g)+H2O(g)[ЗДгІЂђ]ЁЃЮЌГжбЙЧПВЛБфЃЌАДЙЬЖЈГѕЪМЭЖСЯБШНЋCO2КЭH2АДвЛЖЈСїЫйЭЈЙ§ИУДпЛЏМСЃЌОЙ§ЯрЭЌЪБМфВтЕУЪЕбщЪ§ОнЃК
T(K) | CO2ЪЕМЪзЊЛЏТЪЃЈ%ЃЉ | МзДМбЁдёадЃЈ%ЃЉ |
543 | 12.3 | 42.3 |
553 | 15.3 | 39.1 |
зЂЃКМзДМЕФбЁдёадЪЧжИЗЂЩњЗДгІЕФCO2жазЊЛЏЮЊМзДМЕФАйЗжБШЁЃ
БэжаЪ§ОнЫЕУїЃЌЩ§ИпЮТЖШЃЌCO2ЕФЪЕМЪзЊЛЏТЪЬсИпЖјМзДМЕФбЁдёадНЕЕЭЃЌЦфдвђЪЧ_________ЁЃ
ЁОД№АИЁПCH3OH(g)=CH3OH(l) ЁїH=38.19kJ/mol 50% C D ЃО ЃМ ЃО 16 C Щ§ИпЮТЖШЃЌЗДгІЂёЁЂЂђЕФЗДгІЫйТЪОљМгПьЃЌЕЋЗДгІЂђЕФЗДгІЫйТЪБфЛЏИќДѓ
ЁОНтЮіЁП
(1)ИљОнЬтвтЃЌМзДМШМЩеШШЕФШШЛЏбЇЗНГЬЪНЃКCH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ЁїH=726.51kJmol1ЃЌИљОнИЧЫЙЖЈТЩМЦЫуЃЛ
O2(g)=CO2(g)+2H2O(l) ЁїH=726.51kJmol1ЃЌИљОнИЧЫЙЖЈТЩМЦЫуЃЛ
(2)ЂйИљОнЧтЦјЕФЦНКтЗДгІЫйТЪЃЌМЦЫуЧтЦјЕФХЈЖШБфЛЏСПЃЌНјЖјМЦЫуCOзЊЛЏТЪЃЛCO+2H2CH3OH ІЄHЃМ0ЗДгІЗХШШЃЌИљОнЮТЖШЖдЛЏбЇЦНКтвЦЖЏЕФгАЯьЗжЮіЃЛ
ЂкЕБ![]() =2ЃК1ЪБЃЌЦНКтЪБЩњГЩЮяЕФКЌСПзюДѓЃЌЕБ
=2ЃК1ЪБЃЌЦНКтЪБЩњГЩЮяЕФКЌСПзюДѓЃЌЕБ![]() =3.5ЪБЃЌCH3OHЕФЬхЛ§ЗжЪ§аЁгкзюДѓжЕЃЛ
=3.5ЪБЃЌCH3OHЕФЬхЛ§ЗжЪ§аЁгкзюДѓжЕЃЛ
(3)ИљОнгАЯьЛЏбЇЦНКтЕФвђЫиЗжЮіМДПЩЃЛИљОнЭМЯёЃЌНсКЯЁАШ§ЖЮЪНЁБМЦЫуЦНКтГЃЪ§ЃЛ
(4)ЂйдкT1ЮТЖШЯТЃЌЯрЭЌЪБМфФкЃЌЛюЛЏФмдНИпЃЌЗДгІдНРЇФбЃЌCO2зЊЛЏТЪзюаЁЃЛ
ЂкБэИёЪ§ОнБэУїЃЌЩ§ИпЮТЖШЃЌПЩФмЩ§ИпЮТЖШЃЌЗДгІЂёЁЂЂђЕФЗДгІЫйТЪЖММгПьЃЌЕЋЗДгІЂђЕФЗДгІЫйТЪБфЛЏИќДѓЁЃ
(1)вбжЊ ЂйCH3OH(g)+H2O(l)=CO2(g)+3H2(g) ІЄH= + 93.0kJЁЄmolЃ1
ЂкCH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ІЄH=Ѓ192.9 kJЁЄmolЃ1
O2(g)=CO2(g)+2H2(g) ІЄH=Ѓ192.9 kJЁЄmolЃ1
ЂлCH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ЁїH=726.51kJmol1ЃЌ
O2(g)=CO2(g)+2H2O(l) ЁїH=726.51kJmol1ЃЌ
ИљОнИЧЫЙЖЈТЩЂкЁС3-ЂйЁС2-ЂлПЩЕУЃКCH3OH(g)=CH3OH(l) ЁїH=38.19kJ/molЃЛ
(2)Ђй0ЁЋ5minФкЦНОљЗДгІЫйТЪv(H2)=0.1molL-1min-1ЃЌИљОнc(H2)= v(H2)ЁСt=0.1molL-1min-1ЁС5min=0.5mol/LЃЌИљОнCO+2H2CH3OHЃЌCOЕФХЈЖШБфЛЏСП=0.25mol/LЃЌH2КЭCOзмЙВЮЊ3molЃЌЧвЦ№ЪМ![]() =2ЃК1ЃЌПЩжЊH2ЮЊ2molЁЂCOЮЊ1molЃЌЦНКтЪБH2ЮЊ1molЃЌCOЮЊ0.5molЃЌCH3OHЮЊ0.5molЃЌдђИУЬѕМўCOЕФЦНКтзЊЛЏТЪ=
=2ЃК1ЃЌПЩжЊH2ЮЊ2molЁЂCOЮЊ1molЃЌЦНКтЪБH2ЮЊ1molЃЌCOЮЊ0.5molЃЌCH3OHЮЊ0.5molЃЌдђИУЬѕМўCOЕФЦНКтзЊЛЏТЪ=![]() ЁС100%=50%ЃЌЯрЭЌЬѕМўЯТЃЌЬхЛ§жЎБШЕШгкЮяжЪЕФСПжЎБШЃЌДЫЪБH2ЕФЬхЛ§ЗжЪ§ЮЊ
ЁС100%=50%ЃЌЯрЭЌЬѕМўЯТЃЌЬхЛ§жЎБШЕШгкЮяжЪЕФСПжЎБШЃЌДЫЪБH2ЕФЬхЛ§ЗжЪ§ЮЊ![]() =
=![]() ЃЛCO+2H2CH3OH ІЄHЃМ0ЗДгІЗХШШЃЌЦфЫќЬѕМўВЛБфЃЌдкT2Ёц(T2ЃОT1)ЪБЃЌЩ§ИпЮТЖШЦНКтФцЯђвЦЖЏЃЌЧтЦјЕФКЌСПдіДѓЃЌЬхЛ§ЗжЪ§діДѓЃЛ
ЃЛCO+2H2CH3OH ІЄHЃМ0ЗДгІЗХШШЃЌЦфЫќЬѕМўВЛБфЃЌдкT2Ёц(T2ЃОT1)ЪБЃЌЩ§ИпЮТЖШЦНКтФцЯђвЦЖЏЃЌЧтЦјЕФКЌСПдіДѓЃЌЬхЛ§ЗжЪ§діДѓЃЛ
ЂкЛьКЯБШР§ЕШгкЛЏбЇМЦСПЪ§жЎБШЪБЃЌЦНКтЪБЩњГЩЮяЕФКЌСПзюДѓЃЌЙЪЕБ![]() =3.5ЪБЃЌДяЕНЦНКтзДЬЌКѓЃЌCH3OHЕФЬхЛ§ЗжЪ§аЁгкCЕуЃЌЙЪбЁDЃЛ
=3.5ЪБЃЌДяЕНЦНКтзДЬЌКѓЃЌCH3OHЕФЬхЛ§ЗжЪ§аЁгкCЕуЃЌЙЪбЁDЃЛ
(3)гЩЭМЯѓПЩжЊЃЌЩ§ИпЮТЖШCOЕФзЊЛЏТЪдіДѓЃЌМДЩ§ИпЮТЖШЃЌЦНКтЯђе§ЗНЯђвЦЖЏЃЌЫљвдЗДгІЮЊЮќШШЗДгІЃЌМДЁїHЃО0ЃЛгЩЭМЯѓПЩЕУЃЌдкЯрЭЌЮТЖШЯТЃЌplЪБCOЕФзЊЛЏТЪДѓгкp2ЪБCOЕФзЊЛЏТЪЃЌИУЗДгІЕФе§ЗДгІЗНЯђЮЊЦјЬхЬхЛ§діДѓЕФЗНЯђЃЌбЙЧПдНДѓCOЕФзЊЛЏдНаЁЃЌдђplЃМp2ЃЛЕБбЙЧПЮЊp2ЪБЃЌyЕуCOЕФзЊЛЏТЪаЁгкЦНКтxЕуЕФCOЕФзЊЛЏТЪЃЌдђyЕуЗДгІе§ЯђНјааЃЌМДЃЌдкyЕуЃЌv(е§)ЃОv(Фц)ЃЛИљОнЭМЯёЃЌЕБбЙЧПЮЊp2ЪБЃЌМзЭщЕФзЊЛЏТЪЮЊ50%ЃЌСаЁАШ§ЖЮЪНЁБЃК

Шєp2=6MpaЃЌЦНКтЪБЃЌИїЮяжЪЕФзмЮяжЪЕФСПЮЊ0.05+0.05+0.1+0.1=0.3molЃЌдђTЁцЪБИУЗДгІЕФЦНКтГЃЪ§Kp= =16MPa2ЃЛ
=16MPa2ЃЛ
(4)ЂйШчЭМЫљЪОЃЌдкT1ЮТЖШЯТЃЌЯрЭЌЪБМфФкЃЌДпЛЏМСAзїгУЯТЕФзЊЛЏТЪзюДѓЃЌДпЛЏМСCЕФзїгУЯТЕФзЊЛЏТЪзюаЁЃЌЛюЛЏФмдНИпЃЌЗДгІдНРЇФбЃЌCO2зЊЛЏТЪдНЕЭЃЌЙЪД№АИбЁCЃЛ
ЂкБэИёЪ§ОнБэУїЃЌПЩФмЩ§ИпЮТЖШЃЌЗДгІЂёЁЂЂђЕФЗДгІЫйТЪЖММгПьЃЌЕЋЗДгІЂђЕФЗДгІЫйТЪБфЛЏИќДѓЃЌвђДЫЃЌМзДМЕФбЁдёадНЕЕЭЃЌЦфдвђЪЧЩ§ИпЮТЖШЃЌЗДгІЂёЁЂЂђЕФЗДгІЫйТЪОљМгПьЃЌЕЋЗДгІЂђЕФЗДгІЫйТЪБфЛЏИќДѓЁЃ


 ABCПМЭѕШЋгХОэЯЕСаД№АИ
ABCПМЭѕШЋгХОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A.ЧІаюЕчГидкЗХЕчЙ§ГЬжаЃЌе§ИКМЋжЪСПОљдіМг
B.ГЃЮТЯТЃЌЗДгІC(s)+CO2(g)ЃН2CO(g)ВЛФмздЗЂНјааЃЌдђИУЗДгІЕФЁїHЃО 0
C.25ЁцЪБЃЌMg(OH)2ЙЬЬхдк20 mL 0.01 molЁЄL-1АБЫЎжаЕФKspБШдк20 mL 0.01 molЁЄL-1NH4ClШмвКжаЕФKspаЁ
D.НЋХЈЖШЮЊ0.1molЁЄL-1ЕФHFШмвКМгЫЎВЛЖЯЯЁЪЭЃЌ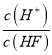 ЕФжЕЪМжеБЃГждіДѓ
ЕФжЕЪМжеБЃГждіДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаAЁЂBЁЂCЁЂDЁЂEЮхжждзгађЪ§діДѓЕФдЊЫиЃЌжЛгавЛжжЮЊН№ЪєЁЃAЁЂBЁЂCОљЮЊЕкЖўжмЦкНєСкдЊЫиЃЌЦфЕквЛЕчРыФмЫГађЮЊB>C>AЃЛBгыDЭЌжїзхЃЛEЮЊЕк4жмЦкИБзхдЊЫиЃЌЦфМлВуЕчзгЮЊШЋТњЁЃ
ЃЈ1ЃЉEдЊЫиЕФУћГЦЮЊ________ЃЌИУдЊЫиЛљЬЌдзгЕФМлЕчзгХХВМЪНЮЊ_______ЁЃ
ЃЈ2ЃЉBгыDЗжБ№гыЧтаЮГЩзюМђЕЅЧтЛЏЮяЗаЕуИпЕЭЫГађЮЊ____ЃЈгУЛЏбЇЪНБэЪОЃЉЃЛдвђ_____ЁЃ
ЃЈ3ЃЉAЁЂBЁЂCШ§жждЊЫиЗжБ№гыЧтаЮГЩЛЏКЯЮяжаЕФM-MЃЈMДњБэAЁЂBЁЂCЃЉЕЅМќЕФМќФмШчЯТБэЃК
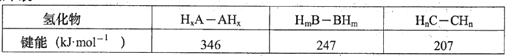
ЩЯЪіШ§жжЧтЛЏЮяжаЃЌAЁЂBЁЂCдЊЫидзгЕФдгЛЏЗНЪНга_____жжЃЛЧыНтЪЭЩЯБэжаШ§жжЧтЛЏЮяM-MЕЅМќЕФМќФмвРДЮЯТНЕЕФдвђ______________________ЁЃ
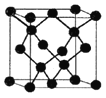
ЃЈ4ЃЉDгыТШаЮГЩЕФЛЏКЯЮяDC15ЃЌМгбЙЬѕМўЯТ148ЁцвКЛЏЃЌЗЂЩњЭъШЋЕчРыЕУЕНвЛжжФмЙЛЕМЕчЕФШлЬхЃЌВтЖЈD-ClМќГЄЮЊ198pmКЭ206pmСНжжЃЌИУШлЬхжаКЌгавЛжже§ЫФУцЬхНсЙЙЕФбєРызгЃЌЧыаДГіИУЬѕМўЯТDC15ЕчРыЕФЕчРыЗНГЬЪН__________ЃЛИУШлЬхжавѕРызгЕФПеМфЙЙаЭЮЊ________ЁЃ
ЃЈ5ЃЉEгыCаЮГЩЕФЛЏКЯЮяОЇЬхНсЙЙгаЫФжжЃЌЦфжавЛжжгыН№ИеЪЏРрЫЦЃЌН№ИеЪЏОЇЬхНсЙЙШчЭМЫљЪОЃЌИУОЇЬхЕФЛЏбЇЪНЮЊ______ЃЈгУдЊЫиЗћКХБэЪОЃЉЃЛИУОЇАћЕФРтГЄЮЊapm дђИУОЇЬхЕФУмЖШЮЊ______g/cm3ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
Ђй![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЪєгкМюадбѕЛЏЮяЃЌ
ЪєгкМюадбѕЛЏЮяЃЌ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЖМФмКЭМюШмвКЗЂЩњЗДгІЪєгкЫсадбѕЛЏЮя
ЖМФмКЭМюШмвКЗЂЩњЗДгІЪєгкЫсадбѕЛЏЮя
ЂкЬМЫсФЦЁЂЧтбѕЛЏБЕЁЂТШЛЏяЇЁЂЙ§бѕЛЏФЦЖМЪєгкРызгЛЏКЯЮя
ЂлЛьКЯЮяЃКЦЏАзЗлЁЂЫЎВЃСЇЁЂ![]() НКЬхЁЂБљЫЎЛьКЯЮя
НКЬхЁЂБљЫЎЛьКЯЮя
ЂмДзЫсЁЂЩеМюЁЂДПМюКЭЩњЪЏЛвЗжБ№ЪєгкЫсЁЂМюЁЂбЮКЭбѕЛЏЮя
ЂнЙшЕМЕчЃЌТСдкХЈСђЫсжаЖлЛЏОљЪєгкЮяРэБфЛЏ
ЂобЮЫсЪєгкЛьКЯЮяЃЌЖјвКТШЁЂБљДзЫсОљЪєгкДПОЛЮя
A.ЂйЂлЂнB.ЂмЂнЂоC.ЂкЂмЂоD.ЂкЂлЂм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПKClO3КЭХЈбЮЫсдквЛЖЈЮТЖШЯТЗДгІЛсЩњГЩЛЦТЬЩЋЕФвзБЌЮяЖўбѕЛЏТШЁЃЦфБфЛЏПЩБэЪіЮЊЃК2KClO3+4HClЃЈХЈЃЉ=2KCl+2ClO2Ёќ+Cl2Ёќ+2H2OЁЃ
ЃЈ1ЃЉЧыЗжЮіИУЗДгІжаЕчзгзЊвЦЕФЧщПі___ЁЃЃЈЫЋЯпЧХЗЈБэЪОЃЉ
ЃЈ2ЃЉХЈбЮЫсдкЗДгІжаЯдЪОГіРДЕФаджЪЪЧ___ЃЈЬюаДБрКХЃЉЁЃ
ЂйжЛгаЛЙдад ЂкЛЙдадКЭЫсад ЂлжЛгабѕЛЏад ЂмбѕЛЏадКЭЫсад
ЃЈ3ЃЉВњЩњ0.1molCl2ЃЌдђзЊвЦЕФЕчзгЕФЮяжЪЕФСПЮЊ___molЁЃ
ЃЈ4ЃЉClO2ОпгаКмЧПЕФбѕЛЏадЁЃвђДЫЃЌГЃБЛгУзїЯћЖОМСЃЌЦфЯћЖОЕФаЇТЪЃЈвдЕЅЮЛжЪСПЕУЕНЕФЕчзгЪ§БэЪОЃЉЪЧCl2ЕФ___БЖЃЈБЃСєаЁЪ§ЕуКѓСНЮЛЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПОљШ§МзБН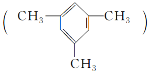 ЪЧвЛжжвзШМЁЂВЛШмгкЫЎЁЂБШЫЎУмЖШаЁЕФгаЖОвКЬхЃЌЪЧживЊЕФгаЛњЛЏЙЄдСЯЃЌгУгкжЦБИКЯГЩЪїжЌЁЂПЙбѕЛЏМСЕШЁЃ
ЪЧвЛжжвзШМЁЂВЛШмгкЫЎЁЂБШЫЎУмЖШаЁЕФгаЖОвКЬхЃЌЪЧживЊЕФгаЛњЛЏЙЄдСЯЃЌгУгкжЦБИКЯГЩЪїжЌЁЂПЙбѕЛЏМСЕШЁЃ
(1)ОљШ§МзБНЪєгкБНЕФЭЌЯЕЮяЃЌбЁгУвЛжжЪдМСЧјБ№БНКЭОљШ§МзБНЃК________________ЁЃ
(2)ОљШ§МзБНЗжзгжаЕФвЛИіHдзгБЛClдзгШЁДњЃЌЫљЕУВњЮяга________жжЁЃ
(3)ЯТСаЪєгкБНЕФЭЌЯЕЮяЕФЪЧ________(ЬюзжФИ)ЁЃ
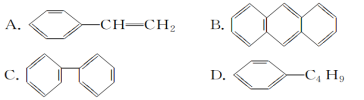
(4)ЯТСаЮяжЪжаЃЌФмЗЂЩњМгГЩЗДгІЃЌвВФмЗЂЩњШЁДњЗДгІЃЌЭЌЪБФмЪЙфхЫЎвђМгГЩЗДгІЖјЭЪЩЋЃЌЛЙФмЪЙЫсадИпУЬЫсМиШмвКЭЪЩЋЕФЪЧ________(ЬюзжФИ)ЁЃ
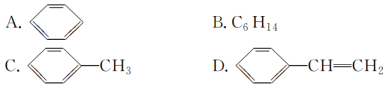
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁППЦбаЙЄзїепНсКЯЪЕбщгыМЦЫуЛњФЃФтРДбаОПюЩДпЛЏМСБэУцВЛЭЌЮЛЕуЩЯКЯГЩАБЗДгІРњГЬЃЌШчЭМЫљЪОЃЌЦфжаЪЕЯпБэЪОЮЛЕуAЩЯКЯГЩАБЕФЗДгІРњГЬЃЌащЯпБэЪОЮЛЕуBЩЯКЯГЩАБЕФЗДгІРњГЬЃЌЮќИНдкДпЛЏМСБэУцЕФЮяжжгУ*БъзЂЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
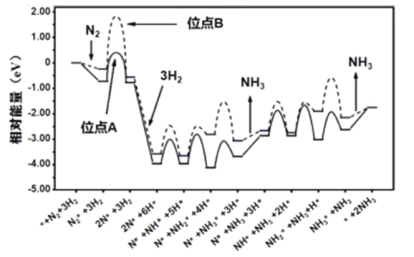
A.гЩЭМПЩвдХаЖЯКЯГЩАБЗДгІЪєгкЗХШШЗДгІ
B.ЕЊЦјдкЮЛЕуAЩЯзЊБфГЩ2N*ЫйТЪБШдкЮЛЕуBЩЯЕФПь
C.ећИіЗДгІРњГЬжаЛюЛЏФмзюДѓЕФВНжшЪЧ2N*+3H2Ёњ2N*+6H*
D.ДгЭМжажЊбЁдёКЯЪЪЕФДпЛЏМСЮЛЕуПЩМгПьКЯГЩАБЕФЫйТЪ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПХ№ЧтЛЏФЦ(NaBH4)дкЛЏЙЄЕШСьгђОпгаживЊЕФгІгУМлжЕЃЌФГбаОПаЁзщВЩгУЦЋХ№ЫсФЦNaBO2ЮЊжївЊдСЯжЦБИNaBH4ЃЌЦфСїГЬШчЯТЃК
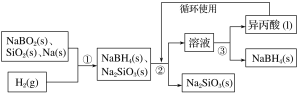
вбжЊЃКNaBH4ГЃЮТЯТФмгыЫЎЗДгІЃЌПЩШмгквьБћЫс(ЗаЕуЃК33 Ёц)ЁЃ
(1)дкЕкЂйВНЗДгІМгСЯжЎЧАЃЌашвЊНЋЗДгІЦїМгШШжС100 ЁцвдЩЯВЂЭЈШыыВЦјЃЌИУВйзїЕФФПЕФЪЧ______________ЃЌдСЯжаЕФН№ЪєФЦЭЈГЃБЃДцдк________жаЃЌЪЕбщЪвШЁгУЩйСПН№ЪєФЦашвЊгУЕНЕФЪЕбщгУЦЗга________ЁЂ________ЁЂВЃСЇЦЌКЭаЁЕЖЕШЁЃ
(2)ЕкЂкВНЗжРыВЩгУЕФЗНЗЈЪЧ________ЃЛЕкЂлВНЗжРы(NaBH4)ВЂЛиЪеШмМСЃЌВЩгУЕФЗНЗЈЪЧ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЯТЭМЫљЪОЃЌНЋСНЩеБгУЕМЯпЯрСЌЃЌPtЁЂCuЁЂZnЁЂЪЏФЋАєЗжБ№ЮЊЫФИіЕчМЋЃЌЕББеКЯПЊЙиКѓЃЌЯТСаа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ
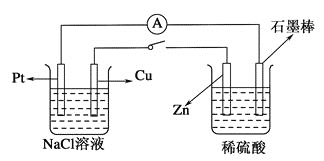
A.CuМЋИННќ![]() ХЈЖШдіДѓ
ХЈЖШдіДѓ
B.CuМЋЮЊЕчНтГибєМЋ
C.ЕчзггЩЪЏФЋАєСїЯђPtМЋ
D.ЕБЪЏФЋАєЩЯга![]() ЕчзгзЊвЦЪБЃЌPtМЋЩЯга
ЕчзгзЊвЦЪБЃЌPtМЋЩЯга![]() ЩњГЩ
ЩњГЩ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com