
【题目】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:
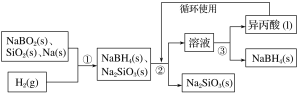
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:33 ℃)。
(1)在第①步反应加料之前,需要将反应器加热至100 ℃以上并通入氩气,该操作的目的是______________,原料中的金属钠通常保存在________中,实验室取用少量金属钠需要用到的实验用品有________、________、玻璃片和小刀等。
(2)第②步分离采用的方法是________;第③步分离(NaBH4)并回收溶剂,采用的方法是________。
【答案】排尽装置中的空气和水蒸气 煤油 镊子 滤纸 过滤 蒸馏
【解析】
(1)在第①步反应加料之前,需要将反应器加热至100 ℃以上并通入氩气,该操作的目的是排尽装置内的空气,防止钠被氧化;原料中的金属钠通常保存在煤油中;实验室取用少量金属钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀等。
(2)第②步是固体与液体分离,采用的方法是过滤;第③步分离(NaBH4)并回收溶剂,采用的方法是利用沸点的差异进行分离。
(1)Na能与空气中的水蒸气、氧气反应,NaBH4常温下能与水反应,因而通入氩气是为了排除干扰因素空气和水,取用钠时,用镊子夹取,用滤纸吸干表面的煤油。答案为:排尽装置中的空气和水蒸气;煤油;镊子;滤纸;
(2)从流程可看出第②步是固体与液体的分离,其操作为过滤。根据已知信息可知NaBH4可溶于异丙酸,且异丙酸的沸点较低(33 ℃),回收异丙酸可选用蒸馏的方法。过滤;蒸馏。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. CH3CH(C2H5)CH2CH(CH3)CH3的名称为2-甲基-4-乙基戊烷
B. ![]() 中至少有16个原子共平面
中至少有16个原子共平面
C. 分子式为C5H10O2的能够发生水解反应和银镜反应的有机物有8种
D. 淀粉和蛋白质水解的最终产物都只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
(1)已知 ①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH= + 93.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③甲醇的燃烧热为726.51kJ·mol-1。
要写出表示甲醇燃烧热的热化学方程式,还缺少的热化学方程式为________________。
(2)甲醇可采用煤的气化、液化制取(CO+2H2CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图所示。
的关系如图所示。
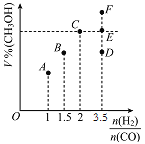
①当起始![]() =2,经过5min达到平衡,0~5min内平均反应速率v(H2)=0.1molL-1min-1,则该条件CO的平衡转化率为_____;若其它条件不变,在T2℃(T2>T1)下达到平衡时CO的体积分数可能是____(填标号)
=2,经过5min达到平衡,0~5min内平均反应速率v(H2)=0.1molL-1min-1,则该条件CO的平衡转化率为_____;若其它条件不变,在T2℃(T2>T1)下达到平衡时CO的体积分数可能是____(填标号)
A.<![]() B.=
B.=![]() C.
C.![]() ~
~ ![]() D.=
D.=![]() E.>
E.> ![]()
②当![]() =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的____点选填“D”、“E”或“F”)。
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的____点选填“D”、“E”或“F”)。
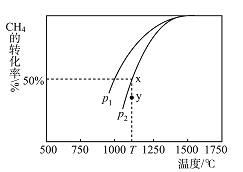
(3)制甲醇的CO和H2可用天然气来制取:CO2(g)+CH4(g)2CO(g)+2H2(g)。在某一密闭容器中有浓度均为0.1mol·L1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH______(选填“大于”“小于”或“等于”)0。压强p1_______(选填“大于”或“小于”)p2。当压强为p2时,在y点:v(正)__________(选填“大于”“小于”或“等于”)v(逆)。若p2=6Mpa,则T℃时该反应的平衡常数Kp=_____MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)研究表明:CO2和H2在一定条件下也可以合成甲醇,反应方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g) [反应Ⅰ]。
①一定条件下,往2L恒容密闭容器中充入2.0mol CO2和4.0mol H2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如下图所示,其中活化能最高的反应所用的催化剂是____(填“A”、“B”或“C”)。

②在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应CO2(g)+H2(g)CO(g)+H2O(g)[反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
T(K) | CO2实际转化率(%) | 甲醇选择性(%) |
543 | 12.3 | 42.3 |
553 | 15.3 | 39.1 |
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是认识和创造物质的科学,下列说法不正确的是( )
A.化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础
B.在人类研究物质微观结构的过程中,光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器先后得到了使用
C.根据酸碱质子理论,CO32-属于酸
D.燃煤烟气脱硫、汽车尾气的消除、二氧化碳的回收均体现了化学对环境保护的贡献
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往10mL0.1mol/L的Ba(OH)2溶液中滴加等浓度NaHSO4溶液,溶液的导电能力随滴入溶液体积变化的曲线如图。下列说法正确的是
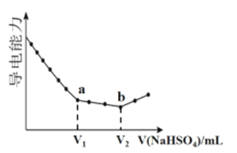
A.a点对应的溶液呈碱性
B.V2=10mL
C.水的电离程度:a> b
D.b点后的溶液满足c(Na+)>2c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH 的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计了如下三种实验方案。
)与NaOH 的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计了如下三种实验方案。
甲:向反应混合液中滴入稀硝酸中和NaOH 溶液,然后滴入AgNO3溶液,若有淡黄色沉淀生成,则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性FeCl3溶液,若溶液颜色变为紫色,则可证明发生了水解反应。
其中正确的是( )
A.甲B.乙
C.丙D.上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
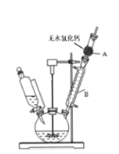
【题目】三苯甲醇(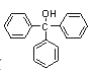 )是重要的有机合成中间体。实验室中合成三苯甲醇时采用如图所示的装置,其合成流程如图:
)是重要的有机合成中间体。实验室中合成三苯甲醇时采用如图所示的装置,其合成流程如图:
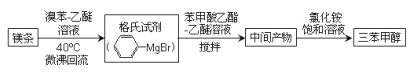
已知:①格氏试剂易潮解,生成可溶于水的 Mg(OH)Br。
②三苯甲醇可通过格氏试剂与苯甲酸乙酯按物质的量比2:1反应合成
③相关物质的物理性质如下:
物质 | 相对分子量 | 沸点 | 熔点 | 溶解性 |
三苯甲醇 | 260 | 380℃ | 164.2℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
乙醚 | - | 34.6℃ | -116.3℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
溴苯 | - | 156.2℃ | -30.7℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
苯甲酸乙酯 | 150 | 212.6℃ | -34.6℃ | 不溶于水 |
请回答下列问题:
(1)合成格氏试剂:实验装置如图所示,仪器A的名称是____,已知制备格氏试剂的反应剧烈放热,但实验开始时常加入一小粒碘引发反应,推测I2的作用是____。使用无水氯化钙主要是为避免发生____(用化学方程式表示)。
(2)制备三苯甲醇:通过恒压滴液漏斗往过量的格氏试剂中加入13mL苯甲酸乙酯(0.09mol)和15mL无水乙醚的混合液,反应剧烈,要控制反应速率除使用冷水浴外,还可以 ___(答一点)。回流0.5h后,加入饱和氯化铵溶液,有晶体析出。
(3)提纯:冷却后析出晶体的混合液含有乙醚、溴苯、苯甲酸乙酯和碱式溴化镁等杂质,可先通过 ___(填操作方法,下同)除去有机杂质,得到固体17.2g。再通过 ___纯化,得白色颗粒状晶体16.0g,测得熔点为164℃。
(4)本实验的产率是____(结果保留两位有效数字)。本实验需要在通风橱中进行,且不能有明火,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39 kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46 kJ/mol
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.84 kJ/mol
O2(g)=H2O(l) ΔH=-285.84 kJ/mol
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于
A.-319.68 kJ/molB.-417.91 kJ/mol
C.-448.46 kJ/molD.+546.69 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚,可以用烃A通过下列路线制得:A
是一种有机烯醚,可以用烃A通过下列路线制得:A![]() B
B![]() C
C![]()
![]() 。则下列说法正确的是( )
。则下列说法正确的是( )
A.![]() 的分子式为C4H4O
的分子式为C4H4O
B.A的结构简式是CH2=CHCH2CH3
C.A能使高锰酸钾酸性溶液褪色
D.①②③的反应类型分别为卤代、水解、消去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com