
【题目】我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是
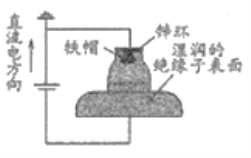
A. 通电时,锌环是阳极,发生氧化反应
B. 通电时,阴极上的电极反应为2H2O+2e-=H2↑+2OH-
C. 断电时,锌环上的电极反应为Zn2++2e-=Zn
D. 断电时,仍能防止铁帽被腐蚀
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ、目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
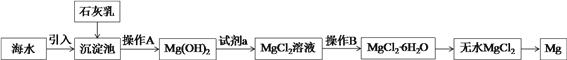
操作A是____________,下列仪器中操作B必须使用的有__________(填字母符号)。
A、锥形瓶 B、玻璃棒 C、表面皿 D、蒸发皿 E、坩埚
Ⅱ、乙醇镁[(CH3CH2O)2Mg] 为白色固体,难溶于乙醚和烃类,略溶于乙醇,在空气中会水解,常用作烯烃聚合催化剂载体和制备精密陶瓷的原料。某小组同学用镁粉(受潮会发生自燃、自爆)与乙醇在实验室中制备乙醇镁:
(1)干燥管中盛装的试剂为_____________,其作用为__________________________。
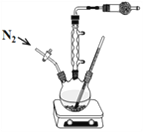
(2)下列操作的合理顺序为:______________。
a、将干燥的氮气通入装置,连续操作数次;
b、称取镁粉,量取无水乙醇加入反应器内;
c、加热回流,控制温度在80℃,反应1小时;
d、开启冷凝水和磁力搅拌器。
(3)将温度控制在80℃的原因是________________,写出生成乙醇镁的化学方程式____________________________。
(4)请你设计实验证明有乙醇镁生成(简述实验的方法):_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)TiCl4水解生成TiO2xH2O的化学方程式为______________________________。
(2)检验TiO2xH2O中Cl-是否被除净的方法是______________________________。
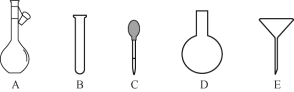
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是__________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的__________(填字母代号)。
(4)滴定终点的判定现象是________________________________________。
(5)滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗cmol/LNH4Fe(SO4)2 标准溶液VmL,则TiO2质量分数表达式为______________________________。
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果__________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。臭氧能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图:呈V形,两个O—O键的夹角为116.5°。三个原子以一个O原子为中心,与另外两个O原子分别构成非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部)——三个O原子均等地享有这4个电子。请回答:
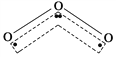
(1)题中非极性共价键是________键,特殊的化学键是________键。
(2)臭氧与氧气的关系是____________________。
(3)下列分子中与O3分子的结构最相似的是(____)
A.H2O B.CO2 C.SO2 D.BeCl2
(4)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有______对孤对电子。
(5)O3具有强氧化性,它能把PbS氧化为PbSO4而O2不能,试配平:___PbS+___O3===___PbSO4+____O2,生成1 mol O2,转移电子的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 、
、![]()
I.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
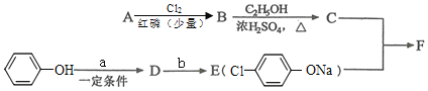
(1)A为一元羧酸,8.8gA与足量NaHCO3溶液反应生成2.24LCO2(标准状况),A的分子式为____________。
(2)写出符合A分子式的所有甲酸酯的结构简式:________________。
(3)B是氯代羧酸,其核磁共振氢谱有两个峰,写出B→C的反应方程式:____________。
(4)C+E→F的反应类型为____________。
(5)写出A和F的结构简式:____________。
(6)D的苯环上有两种氢,它所含官能团的名称为_____________;写出b所代表的试剂为____________。
II.有机物H的分子式为C2H2O3,可发生银镜反应,且具有酸性。
(7)H有多种合成方法,在方框中写出由乙酸合成H的路线流程图(其他原料任选)。合成路线流程图示例如下:![]() ________________________________________________。
________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为周期表中部分元素的某种性质(X值)随原子序数变化的关系。

(1)短周期中原子核外p轨道上电子数与s轨道上电子总数相等的元素是________(写元素符号)。
(2)同主族内不同元素的X值变化的特点是 ________________,同周期内,随着原子序数的增大,X值变化的总趋势是________。周期表中X值的这种变化特点体现了元素性质的____________变化规律。
(3)X值较小的元素集中在元素周期表的________。
a.左下角 b.右上角 c.分界线附近
(4)下列关于元素该性质的说法中正确的是________(选填代号)。
a.X值可反映元素最高正化合价的变化规律
b.X值可反映原子在分子中吸引电子的能力
c.X值大小可用来衡量元素金属性和非金属性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行相关实验,操作正确且能达到实验目的的是
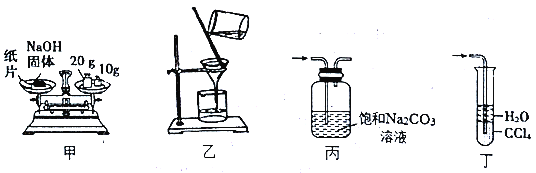
A. 甲装置:称30.0gNaOH固体 B. 乙装置:过滤除去溶液中的不溶性杂质
C. 丙装置:除去CO2中混有的HCl气体 D. 丁装置:吸收实验室制NH3的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列表格
物质 | 分子数 | 质量(g) | 物质的量(mol) | 摩尔质量(g/mol) |
氮气 | _________ | 14 | _________ | 28 |
水 | _________ | _________ | 2 | 18 |
硝酸 | 9.03×1023 | _________ | _________ | 63 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com