
【题目】如图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢原子结合。
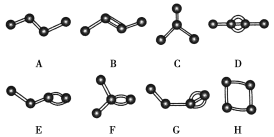
(1)题图中互为同分异构体的是:A与_____;B与_____;D与_____。(填字母,下同)
(2)题图中与甲烷互为同系物的是_____,与乙烯互为同系物的是______。
(3)写出F、G、H的结构简式。F:_______;G:__________;H:________。
【答案】C EFH G A、C B、E、F CH2=C(CH3)CH3 CH3CH2C≡CH ![]()
【解析】
A的结构简式为CH3CH2CH2CH3,化学式为C4H10;B的结构简式为CH3CH=CHCH3,化学式为C4H8;C的结构简式为CH3CH(CH3)CH3,化学式为C4H10;D的结构简式为CH3C≡CCH3,分子式为C4H6;E的结构简式为CH3CH2CH=CH2,化学式为C4H8;F的结构简式为CH2=C(CH3)CH3,化学式为C4H8;G的结构简式为CH3CH2C≡CH,化学式为C4H6;H的结构简式为![]() ,化学式为C4H8。
,化学式为C4H8。
(1)A与C、B与EFH、D与G的分子式相同,结构不同,互为同分异构体,
故答案为:C;EFH;G;
(2)只有A、C中碳原子和其他原子以共价单键结合,属于烷烃,属于甲烷同系物;B、E、F中只含有一个碳碳双键且为链状结构,属于乙烯的同系物,故答案为:A、C;B、E、F;
(3)F的结构简式为CH2=C(CH3)CH3,G的结构简式为CH3CH2C≡CH,H的结构简式为![]() ,故答案为:CH2=C(CH3)CH3;CH3CH2C≡CH;
,故答案为:CH2=C(CH3)CH3;CH3CH2C≡CH;![]() 。
。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,完成下列填空:
I、工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。反应为:N2(g)+3H2(g) ![]() 2NH3(g)+Q。
2NH3(g)+Q。
(2)下列措施可以提高H2的转化率的是(填选项序号)_____________。
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
(3)一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的15/16,则N2的转化率α1=_____;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2___α1 (填“>”、“<”或“=”)。
II、以氨气、空气为主要原料制硝酸。
(4)氨气催化氧化的催化剂是___________;氨气也可以在纯氧中燃烧生成无毒、无污染的产物,其燃烧方程式为_____________。
(5)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)![]() 2NO2(g)-Q。该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)______。
2NO2(g)-Q。该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)______。
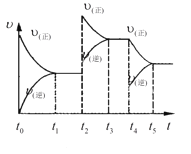
a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
III、硝酸厂常用如下2种方法处理尾气。
(6)催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+ O2(g)→2H2O(g) + 483.6 KJ
N2(g)+ 2O2(g)→2NO2 (g) + 67.7KJ
则H2还原NO2生成水蒸气反应的热化学方程式是_________。
(7)碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。若9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则反应的离子方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验如图所示:
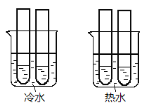
(1)两个烧杯中的试管都分别盛有2 mL 0.1mol/LH2C2O4溶液和4 mL 0.1 mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间。该实验目的是研究____________,但该实验始终没有看到溶液褪色,推测原因________________。
(2)已知草酸(H2C2O4)受热分解的化学方程式为:H2C2O4 → H2O+CO↑+CO2↑,写出FeC2O4在密闭容器中高温分解的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g) ![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。

下列有关说法正确的是
A. 一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234 kJ热量
B. 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C. 若X表示温度,则Y表示的可能是CO2的物质的量浓度
D. 若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,两者互为同分异构体的是 ( )
①CuSO4·5H2O和CuSO4·3H2O ②NH4CNO和CO(NH2)2 ③C2H5NO2和![]()
A.①②③B.②③C.①③D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷的浓硫酸。为研究铁质材料与浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)甲同学将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是________________。
(2)甲同学另称取铁钉10.0 g放入25.0 mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。甲同学认为X中可能含有Fe3+也可能含有Fe2+。若要确认此结论,应用_________选填序号)。
a. KSCN溶液 b. 铁粉和KSCN溶液 c. 氨水 d. 酸性KMnO4溶液
(3)乙同学取448 mL(标准状况)气体Y通入足量溴水中,溴水褪色,发生反应的离子方程式为:______,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为_____。
[探究二]
分析乙同学实验中SO2体积分数的结果,丙同学认为气体Y中除水蒸气外还可能含有Z和W气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
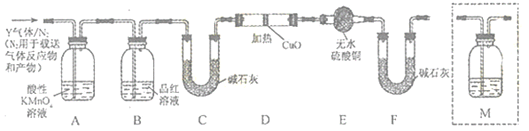
(4)装置B中试剂的作用是____________。
(5)丙同学认为用上图中的D、E、F装置可证明气体Y中还含有Z,则Z气体为_______(化学式),证明Z气体的实验现象为__________;F装置的作用是_________
(6)认为气体Y中还含有W的理由是__________(用化学方程式表示)。为确认W的存在,需在装置中添加M于_______(选填序号)。
a. A之前 b. A-B间 c. B-C间 d. C-D间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法能用平衡移动原理解释的是
A.在电解水实验中,加入硫酸钠可以提高电解效率
B.碳酸氢钠溶液与硫酸铝溶液混合有沉淀和气体生成
C.在一定温度下某容器内发生下列反应:I2(g)+H2(g) ![]() 2HI(g) △H<0,缩小容器的体积,混合气体颜色加深
2HI(g) △H<0,缩小容器的体积,混合气体颜色加深
D.在双氧水中加FeCl3溶液可使产生O2速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学研究铜与浓硫酸的反应装置:
完成下列填空:
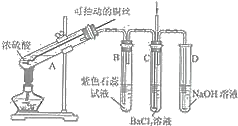
(1)写出A中发生反应的化学方程式______,采用可抽动铜丝进行实验的优点是______。
(2)反应一段时间后,可观察到B试管中的现象为______。
(3)从C试管的直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是______、______.(要求填一种化合物和一种单质的化学式)。
(4)反应完毕,将A中的混合物倒入水中,得到呈酸性的蓝色溶液与少量黑色不溶物,分离出该不溶物的操作是______,该黑色不溶物不可能是CuO,理由是______。
(5)对铜与浓硫酸反应产生的黑色不溶物进行探究,实验装置及现象如下:
实验装置 | 实验现象 |
| 品红褪色 |
①根据实验现象可判断黑色不溶物中一定含有______元素。
②若该黑色不溶物由两种元素组成且在反应前后质量保持不变,推测其化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com