
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)烃A的分子式为_________。
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。则A的结构简式为__________。若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为__________。若烃B的相对分子质量比烃A小6,且B为最简单芳香族化合物,写出B与浓硝酸,浓硫酸混合共热的化学方程式__________
【答案】C6H12 ![]()
![]()
![]() +HNO3(浓)
+HNO3(浓)![]()
![]() +H2O
+H2O
【解析】
(1)用商余法确定分子式为C6H12;
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,则该烃A为烯烃,该分子的一氯取代物只有一种,说明分子中只有1种H原子,分子高度对称,据此书写结构简式;
若A不能使溴水褪色,且其一氯代物只有一种,说明该物质为含有6个C原子的环烷烃,据此书写结构简式;
烃B的相对分子质量比烃A小6,说明B分子比A分子少6个H原子,分子式为C6H6,且B为最简单芳香族化合物,该物质为苯,苯与浓硝酸,浓硫酸混合共热发生取代反应,产生硝基苯和水,据此书写反应的化学方程式。
(1)烃A的相对分子质量是84,84÷12=7,由于C原子相对原子质量是12,H原子相对原子质量是1,烃是由C、H两种元素组成的化合物,1个C原子与12个H原子质量相同,所以该烃分子式为C6H12;
(2)链烃A分子式是C6H12,分子中所有的碳原子在同一平面上,则该烃为烯烃,分子中含有碳碳双键,该分子的一氯取代物只有一种,说明只有一种H原子,其可能结构为:![]() ;
;
若A不能使溴水褪色,说明分子中无碳碳双键,为环烷烃,且其一氯代物只有一种,则分子中6个C原子形成一个环,物质为环己烷,结构简式为:![]() ;
;
烃B的相对分子质量比烃A小6,说明B分子比A分子少6个H原子,分子式为C6H6,且B为最简单芳香族化合物,该物质为苯,苯与浓硝酸,浓硫酸混合加热发生取代反应产生硝基苯和水,反应的化学方程式为:![]() +HNO3(浓)
+HNO3(浓)![]()
![]() +H2O。
+H2O。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。
(2)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有________,由非极性键形成的非极性分子有________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是________,属于离子晶体的是________,属于原子晶体的是________,五种物质的熔点由高到低的顺序是____________________________。
(3)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500℃
试推断它们的晶体类型:
A________;B________;C________;D________。
(4)如图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A________;B________;C________;D________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L和密闭容器中放入4mol N2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g),反应进行到5min时,测得N2O5转化了20%,求:
4NO2(g)+O2(g),反应进行到5min时,测得N2O5转化了20%,求:
(1)5min时,剩余N2O5的物质的量________;
(2)前5min,v(NO2)为多少__________;
(3)5min时,O2的物质的量占混合气体总物质的量的百分比_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎纸条的作用是________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”或“无影响”)。
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1 NaOH溶液各50 mL进行实验,其中NaOH溶液浓度大于盐酸浓度的作用是______,当室温低于10 ℃时进行实验,对实验结果会造成较大的误差,其原因是_____________。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求得的中和热________(填“相等”或“不相等”),简述理由: ______________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为·![]() ·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:A________,B______,C________,D________。
(2)D元素在周期表中属于第________周期______族。
(3)用电子式表示A的气态氢化物的形成过程:____________。
(4)A和B的单质充分反应生成的化合物的结构式是___________。
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明?_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组在学习了Na2O2与CO2的反应后,认为Na2O2与SO2应该也可以反应。他们设计了下图装置![]() 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好![]() 进行实验,探究Na2O2与SO2反应的产物,请按要求回答下列问题。
进行实验,探究Na2O2与SO2反应的产物,请按要求回答下列问题。
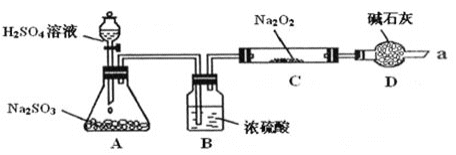
⑴写出装置A中发生反应的化学方程式:_________
⑵装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以__________。
⑶在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;
假设2:_________;
假设3:既有Na2SO3,又有Na2SO4。
a、为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4,该方案是否合理__________![]() 填“是”或“否”
填“是”或“否”![]() ,理由是_______。
,理由是_______。
b、若假设2成立,写出SO2与Na2O2反应的化学方程式:_________。
c、乙同学设计了如下实验进一步确认产物的成分。
实验步骤 | 现象 |
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解。 | 固体全部溶解 |
②向上试管中加入过量的稀盐酸,将生成的气体通入少量酸性KMnO4溶液中。 | 酸性KMnO4溶液褪色 |
③向步骤②反应后的试管中,加入适量的BaCl2溶液。 | 产生白色沉淀 |
步骤②中将产生的气体通入少量酸性KMnO4溶液中,发生反应的离子方程式为: ________,通过上述实验现象确定假设__________成立。(选填1、2或3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.35Cl2与37Cl2互称同位素
B.白磷和红磷互为同素异形体
C.戊烷共有三种同分异构体,其沸点各不相同
D.(CH3)3CCH=CHCH3与H2加成反应后的产物名称是2,2-二甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的是(夹持仪器未画出)( )
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 用于检验溴丙烷消去产物 | 用于石油的分馏 | 用于实验室制硝基苯 | 用于实验室制备乙烯 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com