
【题目】(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。
(2)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有________,由非极性键形成的非极性分子有________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是________,属于离子晶体的是________,属于原子晶体的是________,五种物质的熔点由高到低的顺序是____________________________。
(3)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500℃
试推断它们的晶体类型:
A________;B________;C________;D________。
(4)如图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A________;B________;C________;D________。

【答案】离子键 共价键 分子间作用力 CO2 H2 H2、CO2、HF HF (NH4)2SO4 SiC SiC>(NH4)2SO4>HF>CO2>H2 金属晶体 分子晶体 离子晶体 原子晶体 氯化铯 氯化钠 二氧化硅 金刚石
【解析】
(1)氯酸钾是离子晶体,熔化时破坏离子键;二氧化硅是原子晶体,熔化时破坏共价键;碘是分子晶体,升华时粒子间克服分子间作用力;故答案为:离子键;共价键;分子间作用力;
(2)由极性键形成的非极性分子有CO2,由非极性键形成的非极性分子有H2,能形成分子晶体的物质是H2、CO2、HF,含有氢键的晶体的化学式是 HF,属于离子晶体的是(NH4)2SO4,属于原子晶体的是SiC,五种物质的熔点由高到低的顺序是 SiC>(NH4)2SO4>HF>CO2>H2,故答案为:CO2;H2;H2、CO2、HF;HF;(NH4)2SO4;SiC;SiC>(NH4)2SO4>HF>CO2>H2;
(3)根据晶体的物理性质分析,
A.固态时能导电,能溶于盐酸,属于金属晶体;
B.能溶于CS2,不溶于水,属于分子晶体;
C.固态时不导电,液态时能导电,可溶于水,属于离子晶体;
D.固态、液态时均不导电,熔点为3 500℃,属于原子晶体;
故答案为:金属晶体;分子晶体;离子晶体;原子晶体;
(4)由晶胞结构模型可知A、B、C、D分别为氯化铯、氯化钠、二氧化硅、金刚石,故答案为:氯化铯;氯化钠;二氧化硅;金刚石;


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g) ΔH<0,升高温度可使平衡向逆反应方向移动
CO2(g)+NO(g) ΔH<0,升高温度可使平衡向逆反应方向移动
B. 合成NH3的反应,为提高NH3的产率,理论上应采取相对较低的温度
C. 溴水中存在平衡:Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
D. 对2HI(g)![]() H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深
H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
I.过氧化钙的制备。流程如下,步骤②的装置示意图为图一:
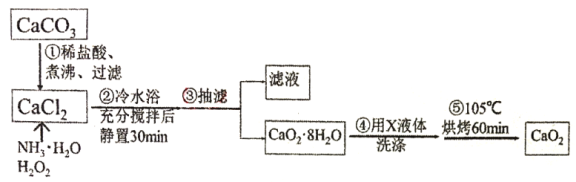

(1)步骤①将溶液煮沸、过滤。将溶液煮沸的目的是___。
(2)图一装置中:①仪器a的名称是___;
②反应的化学方程式为___;
③该反应需要在冷水浴中进行,原因是___。
(3)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是___。
Ⅱ.过氧化钙的测定:已知CaO2在350℃时迅速分解生成CaO和O2。该小组采用如图二所示装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
(1)量气管读数时需注意的项有:①气体冷却到室温;②量气装置两侧液面相平;③___。
(2)使用电子天平准确称取0.5000g样品,置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况)气体,则产品中CaO2的质量分数为___(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是( )
A.工业上N2与H2合成NH3,往往需要使用催化剂
B.密闭容器中2molCO与1molH2O(g)充分反应达平衡后,增大压强CO的反应速率加快
C.SO2与O2催化氧化成SO3是一个放热过程,450℃左右的温度比室温更有利于SO3生成
D.向1.50mol/L的硝酸铵溶液中加入少量氨水至中性,水的电离程度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组通过实验研究NO2的性质,已知:2NO2+2NaOH=NaNO2+NaNO3+H2O 利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
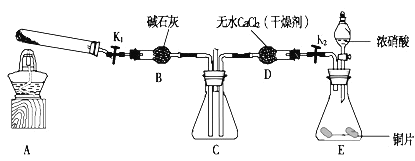
(1)E装置中制取NO2反应的离子方程式是______。
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取______ 。
a.NH4HCO3 b.NH4Cl c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是______。
(4)实验过程中,未能观察到C装置中的预期现象,该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③______ 。
(5)此实验装置存在一个明显的缺陷是 ______。
(6)探究NO2能否与Na2O2发生氧化还原反应,为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。
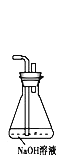
装置的合理连接顺序是 ______,实验过程中,B装置中淡黄色粉末逐渐变成白色,经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项内容,排列顺序正确是( )
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②常见离子的还原性排序:S2->I->Fe2+
③微粒半径:K+>S2->F-
④给出质子的能力:CH3COOH>C2H3OH>H2O
⑤氢化物的沸点:H2Se>H2S>H2O
A.①③B.②④C.①②D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示实验,探究反应中的能量变化。
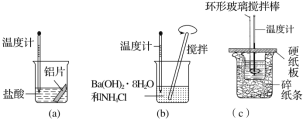
下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响
D.若用NaOH固体测定中和热,则测定中和热的数值偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用。已知![]() 的电离常数:
的电离常数:![]() ,
,![]() ;
;![]() 电离常数:
电离常数:![]()
⑴![]() 溶液的pH______
溶液的pH______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
⑵用惰性电极电解饱和草酸溶液可制得乙醛酸![]() 。阴极的电极反应式为_____。
。阴极的电极反应式为_____。
⑶草酸钠是一种重要的还原剂。合成草酸钠的操作如下:草酸![]()
![]()
![]() 草酸钠晶体
草酸钠晶体
![]() 酒精的作用是________________。
酒精的作用是________________。
![]() 当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中
当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中![]() 。请将该溶液中离子浓度按由大到小的顺序排列______。
。请将该溶液中离子浓度按由大到小的顺序排列______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)烃A的分子式为_________。
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。则A的结构简式为__________。若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为__________。若烃B的相对分子质量比烃A小6,且B为最简单芳香族化合物,写出B与浓硝酸,浓硫酸混合共热的化学方程式__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com