
【题目】下列各项内容,排列顺序正确是( )
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②常见离子的还原性排序:S2->I->Fe2+
③微粒半径:K+>S2->F-
④给出质子的能力:CH3COOH>C2H3OH>H2O
⑤氢化物的沸点:H2Se>H2S>H2O
A.①③B.②④C.①②D.③⑤
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. 向0.1 mol·L1 Na2CO3溶液中通入适量CO2气体后:c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. 常温下,pH=6的NaHSO3溶液中:c(![]() )c(H2SO3)=9.9×107 mol·L1
)c(H2SO3)=9.9×107 mol·L1
C. 等物质的量浓度、等体积的Na2CO3和NaHCO3混合:![]() <
<![]()
D. 0.1 mol·L1 Na2C2O4溶液与0.1 mol·L1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放。
(1)用化学方程式表示NO形成硝酸型酸雨的反应______
(2)能作脱除剂的物质很多,下列说法正确的是______
a.用H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
(3)尿素[CO(NH2)2]在一定条件下能有效将NOx转化为N2
Ⅰ.已知可通过下列方法合成尿素:2NH3(g)+CO2(g)![]() H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
①尿素释放出NH3的热化学方程式是______。
②写出有利于尿素释放NH3的条件并说明理由______。
ⅡCO(NH2)2与某种烟气![]() 主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
①曲线a对应CO(NH2)2与NO的物质的量比值是______。
②曲线a、b、c中,800℃~900℃区间内发生主要反应的化学方程式是______。
③900℃~1200℃区间内脱除率下降,NO浓度上升,发生的主要反应是______。
④曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为______mg/(m3·s) 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。
(2)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有________,由非极性键形成的非极性分子有________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是________,属于离子晶体的是________,属于原子晶体的是________,五种物质的熔点由高到低的顺序是____________________________。
(3)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500℃
试推断它们的晶体类型:
A________;B________;C________;D________。
(4)如图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A________;B________;C________;D________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为二元弱酸,
为二元弱酸,![]() ,
,![]() ,设
,设![]() 溶液中
溶液中![]() 。室温下用NaOH溶液滴定
。室温下用NaOH溶液滴定![]() 溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的溶液:
的溶液:![]()
C.![]() 的溶液:
的溶液:![]()
D.![]() 的溶液:
的溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学原理的相关知识填空。
⑴常温时,![]() 的水溶液呈酸性,原因是
的水溶液呈酸性,原因是![]() 用离子方程式表示
用离子方程式表示![]() :___________,将
:___________,将![]() 溶液蒸干,灼烧,最后得到的固体产物主要是__________
溶液蒸干,灼烧,最后得到的固体产物主要是__________![]() 填化学式
填化学式![]() 。
。
⑵向![]() 溶液滴加石蕊溶液后变红,则
溶液滴加石蕊溶液后变红,则![]() 的电离程度______其水解程度
的电离程度______其水解程度![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]() 。该物质能_______
。该物质能_______![]() 填“促进”或“抑制”
填“促进”或“抑制”![]() 水的电离。
水的电离。
⑶若想除去![]() 溶液中混有
溶液中混有![]() 杂质,则往往加入试剂 ________。
杂质,则往往加入试剂 ________。
![]()
![]()
![]()
![]()
⑷泡沫灭火器的灭火原理为___________![]() 用离子方程式解释
用离子方程式解释![]()
⑸在苏打溶液中存在的电荷守恒式为__________;质子守恒式为__________
⑹常温下,物质的量浓度相同的下列溶液:![]()
![]()
![]()
![]()
![]() 溶液中
溶液中![]() 从大到小排列顺序为________
从大到小排列顺序为________![]() 填序号
填序号![]() 。
。
⑺现有a.醋酸、b.盐酸、c.硫酸三种溶液,根据要求答题。
![]() 若它们物质的量浓度相等,它们的pH由大到小的关系为_______(用abc表示,下同)。
若它们物质的量浓度相等,它们的pH由大到小的关系为_______(用abc表示,下同)。
![]() 若它们的pH相等,它们物质的量浓度由大到小的关系为_____。
若它们的pH相等,它们物质的量浓度由大到小的关系为_____。
![]() 若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为________。
若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们认识最早的盐是食盐,![]() 尚书
尚书![]() 说命
说命![]() 记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对
记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对![]() 、
、![]() 、
、![]() 、
、![]() 四种常见的盐进行探究。回答下列问题:
四种常见的盐进行探究。回答下列问题:
⑴已知![]() 时,AgCl的溶度积为
时,AgCl的溶度积为![]() ,则AgCl在
,则AgCl在![]() 溶液中的
溶液中的![]() 为________
为________![]() 。
。
⑵![]() 时,
时,![]() 溶液的
溶液的![]() ,则关于该溶液中
,则关于该溶液中![]() 的说法正确的是________。
的说法正确的是________。
A.与m无关的定值 ![]() 与m有关的定值
与m有关的定值 ![]() 与
与![]() 有关的不定值
有关的不定值
⑶![]() 时,将
时,将![]() 溶液和
溶液和![]() 溶液各
溶液各![]() 混合,此时混合溶液的
混合,此时混合溶液的![]() ,则
,则![]() 的电离平衡常数
的电离平衡常数![]() ________
________![]() 用含n的表达式表示
用含n的表达式表示![]() 。
。
⑷将![]() 、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜
、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜![]() ,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为
,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为![]() ,另一份高温灼烧后只得到
,另一份高温灼烧后只得到![]() 固体。所得数据显示
固体。所得数据显示![]() ,则该碱式硫酸铜的化学式中
,则该碱式硫酸铜的化学式中![]() ________。
________。
⑸![]() 时,向
时,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的盐酸
的盐酸![]() ,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量
,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量![]() 纵轴
纵轴![]() 也发生变化,如图所示:
也发生变化,如图所示:
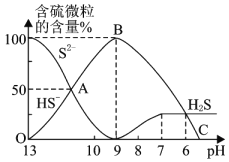
![]() 反应到A点时,溶液中的离子浓度大小的关系为________。
反应到A点时,溶液中的离子浓度大小的关系为________。
![]() 点对应的溶液中大量存在的溶质是________。
点对应的溶液中大量存在的溶质是________。
![]() 混合溶液的
混合溶液的![]() ________时,溶液中开始有
________时,溶液中开始有![]() 气体放出。
气体放出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com