
【题目】氮和硫的氧化物的综合利用是目前研究的热点之一。回答下列问题:
I.NO2可以分解成物质的量之比为1:1的两种氮的氧化物,,其中还原产物的化学式可能为___。
II.已知:
i.N2(g)+O2(g)![]() 2NO(g) △H=+180.0 kJ·mol-1
2NO(g) △H=+180.0 kJ·mol-1
ii.2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
iii.2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1
(1)反应iV:2NO2(g)+2SO2(g)![]() 2SO3(g)+N2(g)+O2(g)的 △H=__________;该反应在密闭容器中达到平衡后,只改变下列条件,一定能使N2的平衡体积分数增大的是__________(填选项字母)。
2SO3(g)+N2(g)+O2(g)的 △H=__________;该反应在密闭容器中达到平衡后,只改变下列条件,一定能使N2的平衡体积分数增大的是__________(填选项字母)。
A.缩小容器容积 B.再充入SO2 C.降低温度 D.分离出SO3
(2)T1°C时,容积相等的密闭容器中分别充入NO2和SO2的混合气体4 mol,发生反应iV。NO2或SO2的平衡转化率(a)与起始充入的![]() 关系如图1所示。
关系如图1所示。
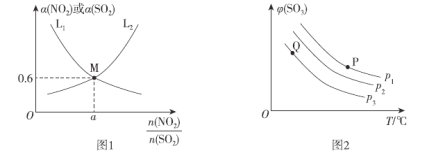
①图中能表示平衡时a(SO2)与起始充入的![]() 关系的曲线为__________(填“L1”或“L2”),理由为___________________;
关系的曲线为__________(填“L1”或“L2”),理由为___________________;
②反应的平衡常数K=________。
(3)向密闭容器中充入一定量SO2和O2,发生反应ii。SO3的平衡体积分数(φ)与温度(T)和压强(p)的关系如图2所示。
①p1、p2、p3由大到小的顺序为_______________。
②P.Q两点对应状态下,单位体积内反应物活化分子数目:P__________Q(填“>”、“<”或“=”),判断依据为____________________________。
【答案】N2O3或NO -263.6 kJ/mol CD L2 随着起始充入的![]() 增大,SO2的平衡转化率增大
增大,SO2的平衡转化率增大 ![]() p1>p2>p3 > P点状态的压强更大,温度更高
p1>p2>p3 > P点状态的压强更大,温度更高
【解析】
I.NO2可以分解成两种含氮氧化物,物质的量之比为1:1,根据氧化还原反应,NO2中氮元素化合价既升高又降低,则其中一种氧化物为N2O5,根据电子守恒和元素守恒可得另一种可能为N2O3或NO且在反应中作还原剂;
II.(1)已知:i.N2(g)+O2(g)![]() 2NO(g) △H=+180.0 kJ·mol-1
2NO(g) △H=+180.0 kJ·mol-1
ii.2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
iii.2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1
根据盖斯定律:反应iV= ii-i-iii可得:2NO2(g)+2SO2(g)![]() 2SO3(g)+N2(g)+O2(g)的 △H=-263.6kJ/mol;
2SO3(g)+N2(g)+O2(g)的 △H=-263.6kJ/mol;
反应iV 为放热反应,反应前后气体体积不变的平衡体系;
A.缩小容器容积,等于增大压强,由于反应前后气体体积不变,平衡不移动,N2的平衡体积分数不变,故A不符合题意;
B.再充入SO2的量无限大时,N2的平衡体积分数减小,故B不符合题意;
C.降低温度平衡正反应方向移动,N2的平衡体积分数增大,故C符合题意;
D.分离出SO3,气体的总物质的量减少,平衡向正向移动,N2的物质的量增大,从而N2的平衡体积分数增大,故D符合题意;
答案选CD;
(2)①随着起始冲入的![]() 增大,NO2的平衡转化率减小,SO2的平衡转化率增大,故能表示平衡时a(SO2)与起始充入的
增大,NO2的平衡转化率减小,SO2的平衡转化率增大,故能表示平衡时a(SO2)与起始充入的![]() 关系的曲线为L2;
关系的曲线为L2;
②当NO2和SO2的平衡转化率相等时,起始充入的![]() =1,即二者的物质的量均为2mol,由图1可知,此时NO2和SO2的平衡转化率为60%,列“三段式”:
=1,即二者的物质的量均为2mol,由图1可知,此时NO2和SO2的平衡转化率为60%,列“三段式”:

反应的平衡常数K=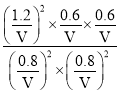 =
=![]() ;
;
(3)①反应ii为气体分子数减小的反应,相同温度下,压强越大,O2的平衡体积分数越大,故p1、p2、p3由大到小的顺序为p1>p2>p3;
②由图像及①分析可得,P、Q两点对应状态下,P点状态的压强更大,温度更高,单位体积内反应物活化分子数目更多,则P>Q。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在探究柠檬电池的工作原理时,某课外小组同学发现:当按图Ⅰ所示连接一个柠檬时,二极管不发光;按图Ⅱ所示连接几个柠檬时,二极管发光。下列说法不正确的是

A. 图Ⅰ中二极管不发光,说明该装置不构成原电池
B. 图Ⅱ中铁环为负极、铜线为正极,负极的电极反应为:Fe-2 e-===Fe2+
C. 图Ⅰ中二极管不发光的原因是单个柠檬电池的电压较小
D. 图Ⅱ中所得的电池组的总电压是各个柠檬电池的电压之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
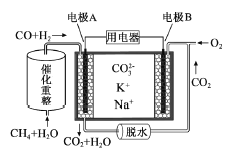
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中铁棒上析出铜,而铁的质量不变,符合要求的原电池是
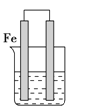
A.铁棒做负极,铜棒做正极,电解质溶液是CuSO4溶液
B.锌棒做负极,铁棒做正极,电解质溶液是CuSO4溶液
C.锌棒做负极,铁棒做正极,电解质溶液是FeCl3溶液
D.铁棒做负极,铜棒做正极,电解质溶液是H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别调节浓度均为0.1 mol·L-1 HA溶液、HB的溶液的pH,所得溶液中酸分子的百分含量ω%(如HA的百分含量为![]() ×100%)与pH的变化关系如图所示。已知调节pH时不影响溶液总体积。下列说法不正确的是
×100%)与pH的变化关系如图所示。已知调节pH时不影响溶液总体积。下列说法不正确的是
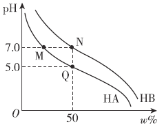
A.常温下,Ka(HA)=1.0×10-5B.M、N两点对应离子浓度:c(A-)=c(B-)
C.将M、N两点溶液等体积混合,溶液呈中性D.水的电离程度:M=N>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在 Cu-ZnO-ZrO2 催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+*H,带*标记的物质是该反应历程中的中间产物或过渡态)。下列说法错误的是
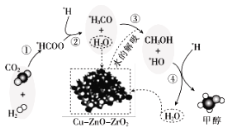
A.第①步中CO2和H2分子中都有化学键断裂
B.水在整个历程中可以循环使用,整个过程不消耗水也不产生水
C.第③步的反应式为:*H3CO+H2O→CH3OH+*HO
D.第④步反应是一个放热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y、Z的原子序数依次增大,且都不超过10.这四种元素可组成一种化合物的结构如图所示。下列说法正确的是( )
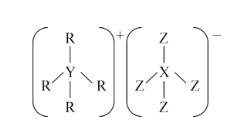
A.常温常压下,上述元素的单质都呈气态
B.最高价氧化物对应水化物的酸性:X>Y
C.Y、Z的气态氢化物能发生化合反应
D.由R、X两种元素只能形成一种化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com