

| ||
| 装置 | 实验药品 |
| A | NH4Cl、Ca(OH)2 |
| B | b:NH3?H2O(aq) a:CaO或 NaOH或CaO、NaOH |


科目:高中化学 来源: 题型:
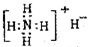


18 8 |
| A、②③⑥ | B、①③⑤⑥ |
| C、③⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C为非气态 |
| B、C为气态 |
| C、第二次达到平衡时C为气态 |
| D、第三次达到平衡时C为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
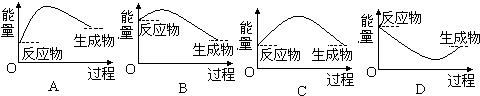
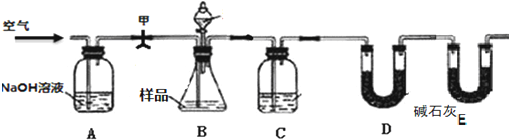
查看答案和解析>>
科目:高中化学 来源: 题型:
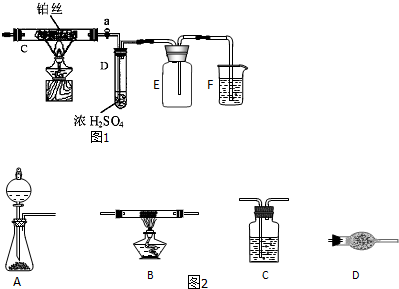
查看答案和解析>>
科目:高中化学 来源: 题型:
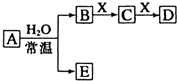 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2-甲基-2-丁烯不存在顺反异构体 |
| B、羟基(-OH)和氢氧根(OH)的电子数相同 |
| C、苯酚钠溶液中通入CO2生成苯酚,则苯酚的酸性比碳酸弱 |
| D、光照下2,2-二甲基丙烷与Br2反应,其一溴取代物只有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com