
【题目】浓度均为0.1 mol / L的①NaHCO3、②Na2CO3、③NaCl、④NaHSO4四种溶液,按pH值由小到大排列的顺序是
A. ①②③④ B.④③①② C.③④①② D.②①④③
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:

回答下列有关问题:
(1)硼砂中B的化合价为 ,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应原理为 Mg+H2O2+2H+===Mg2++2H2O, 则正极反应式为 。常温下,若起始电解质溶液pH=1,则pH=2时,溶液中Mg2+浓度为______。当溶液pH=6时, (填“有”或“没有”)Mg(OH)2沉淀析出(已知Ksp[Mg(OH)2]=5.6×10-12)。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为____(提示:I2+2S2O===2I-+S4O)(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是( )
A. 向氢氧化钾溶液中滴加少量氯化铝溶液Al3++4OH-=AlO2-+2 H2O
B. 向(NH4)2SO4溶液中加入足量Ba(OH)2:Ba2++SO42-=BaSO4↓
C. 碳酸氢钠溶液中加入过量氢氧化钠溶液 HCO3- + OH- =CO32- + H2O
D. 向浓硝酸中加入铜片:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺铂[Pt(NH3)2Cl2]是1969年发现的第一种具有抗癌活性的金属配合物;碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,结构简式如图所示,其毒副作用低于顺铂。下列说法正确的是( )

A. 碳铂中所有碳原子在同一个平面中
B. 顺铂分子中氮原子的杂化方式是sp2
C. 碳铂分子中sp3杂化的碳原子与sp2杂化的碳原子之比为2∶1
D. 1 mol 1,1-环丁二羧酸含有σ键的数目为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在容积为10L固定的密闭容器中充入4molNH3和5molO2发生如下反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),5s后,达到平衡并生成1molNO时:
4NO(g)+6H2O(g),5s后,达到平衡并生成1molNO时:
(1)O2的转化率为__________________。
(2)下列能说明该反应已经达到平衡状态的是____________。(填字母选项)
A.容器中气体总质量不变 B.c(O2)不变
C.5v(O2)正 = 4v(NO)逆 D.体系压强不变
(3)降低容器的温度则反应速率______,向该容器中通入Ar,则反应速率_______(选填“增大”、“减小”、“不变”)。
(4)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是________。(填字母选项)。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢
(5)已知对于可逆化学反应mA + nB ![]() pC + qD在一定温度下达到化学平衡时,其平衡常数K的表达式为:
pC + qD在一定温度下达到化学平衡时,其平衡常数K的表达式为:![]() (其中,C为各物质的平衡浓度),则该温度下,上述反应的平衡常数K = ___________________________(用数据表达,列出式子即可)。
(其中,C为各物质的平衡浓度),则该温度下,上述反应的平衡常数K = ___________________________(用数据表达,列出式子即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸在水中电离方程式可表示为:CH3COOH![]() CH3COO—+H+ ΔH>0,下列操作能使H+ 浓度增大的是 ( )
CH3COO—+H+ ΔH>0,下列操作能使H+ 浓度增大的是 ( )
A. 加入少量NaOH固体 B. 小心加热升温10oC C. 加入锌粉 D. 加入固体CH3COONa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Na2CO3溶液中CO32-水解:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. Fe3O4溶于稀HNO3:3Fe3O4+28H++NO3- = 9Fe3++NO↑+14H2O
C. 少量的SO2通入NaClO溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+
D. 向含Ba(OH)2和KOH均为0.1mol的混合溶液中通入标准状况下4.48LCO2气体:Ba2++3OH-+2CO2=BaCO3↓+HCO3-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为_______。
(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是______ (用元素符号表示)
(3)As4O6的分子结构如左下图所示,其中As原子的杂化方式为______________,1 mol As406含有σ键的物质的量为_______。


(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右上图所示。则Y轴可表示的氢化物(RH3)性质可能是__________。
A.稳定性 B.沸点 C.R-H键能 D.分子间作用力
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是_____________________
(6)NH4+中的H—N—H的键角比 NH3中的H—N—H的键角_______(填”大”或”小”),原因是_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组欲探究SO2的化学性质,设计了如下实验方案。
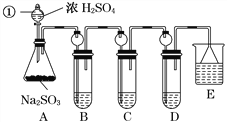
(1)指出仪器①的名称:______________。
(2)检查A装置的气密性的方法是______________________________________________。
(3)装置B检验SO2的氧化性,则B中所盛试剂可以为________。
(4)装置C中盛装溴水用以检验SO2的________性,则C中反应的离子方程式为
________________________________________________________________________。
(5)装置D中盛装新制漂白粉浓溶液,通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为__________________________________________________;
假设三:该白色沉淀为上述两种物质的混合物。
②基于假设一,同学们对白色沉淀成分进行了探究。设计如下方案:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1HCl、0.5 mol·L-1H2SO4、0.5 mol·L-1BaCl2、1 mol·L-1NaOH、品红溶液。
第1步,将D中沉淀过滤、洗涤干净,备用。
请回答洗涤沉淀的方法:____________________________________________________。
第2步,用另一只干净试管取少量沉淀样品,加入________(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有________(试剂)的试管中。若出现__________________现象,则假设一成立。
③若假设二成立,试写出生成该白色沉淀的化学方程式:_________________________________。
(6)装置E中盛放的试剂是________,作用是__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com