
【题目】下列离子方程式书写不正确的是( )
A. 向氢氧化钾溶液中滴加少量氯化铝溶液Al3++4OH-=AlO2-+2 H2O
B. 向(NH4)2SO4溶液中加入足量Ba(OH)2:Ba2++SO42-=BaSO4↓
C. 碳酸氢钠溶液中加入过量氢氧化钠溶液 HCO3- + OH- =CO32- + H2O
D. 向浓硝酸中加入铜片:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 阳离子中一定含有金属元素
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从化合态变为游离态时,该元素一定被还原
D. 金属阳离子被还原不一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气
B.雷雨天气时空气中能生成少量的氮氧化物
C.铵盐易溶于水,化学性质稳定,受热不易分解
D.O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的试剂或方法不正确的是
A. Na2CO3粉末(NaHCO3),加热直至固体质量不再减少
B. NaHCO3溶液(Na2CO3),向溶液中通入过量的CO2气体
C. CO2(HCl),将气体依次通过Na2CO3溶液和浓硫酸中
D. H2(HCl),将气体通入碱石灰中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1)300℃时,该反应的平衡常数表达式为K=______________,已知K300℃<K350℃,则ΔH____0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
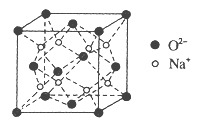
【题目】H、C、N、O、Na、Fe、Cu是常见的七种元素。
(1)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是____________。
(2)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是______(填写序号)。
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
(3)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为___________,1个分子中含有_________个π键。
(4)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为_____________。已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长![]() _______cm。(用含ρ、NA的代数式表示)
_______cm。(用含ρ、NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、铁能形成多种价态的化合物,单质铁能被众多的氧化剂所氧化。
(1)将5.6g的生铁与足量的稀盐酸反应,生成H2的质量______0.2g(填“>”“<”“=”),向此生铁上滴加几滴稀硝酸,写出反应的离子方程式:___________________________。
(2)配制FeCl3溶液时常会出现浑浊现象,其原因是______________________(用离子方程式表示)。室温下配制5mol/L 200mL FeCl3溶液,至少需要添加_______mL 2mol/L的盐酸才会不出现浑浊(已知室温时Ksp[Fe(OH)3]=4.0×10-38,忽略加入盐酸对溶液体积的影响)。
(3)钢铁制品易生锈,导致其生锈的最主要原因是发生了________腐蚀;用NaOH、NaNO2等溶液对铁制品进行钝化处理可提高其抗腐蚀能力,下面是处理过程中所发生的一个反应:____Na2FeO2+_____NaNO2+_____H2O===_____Na2Fe2O4+_____NH3↑+_____,请完善该反应方程式。
II、硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为
NO2(g)+SO2(g)![]() SO3(g)+NO(g)△H=-41.8kJ·mol-1
SO3(g)+NO(g)△H=-41.8kJ·mol-1
(1)下列说法中可以说明该反应已达到平衡状态的是_________。
a. 体系内混合气体的密度保持不变 b. ![]()
c. 容器内气体的总压强保持不变 d. NO体积分数不再改变
(2)某温度下,NO2(g)+SO2(g)![]() SO3(g)+NO(g)的平衡常数k=2.25,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示。
SO3(g)+NO(g)的平衡常数k=2.25,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示。
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol/L | 0.10 | 0.20 | 0.20 |
c(SO2)/mol/L | 0.10 | 0.10 | 0.20 |
①10min后,甲中达到平衡,则甲中反应的平均速率![]() ___________。
___________。
②丙达到平衡所用的时间_________(填“<”“>”“=”)10min,达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1 mol / L的①NaHCO3、②Na2CO3、③NaCl、④NaHSO4四种溶液,按pH值由小到大排列的顺序是
A. ①②③④ B.④③①② C.③④①② D.②①④③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“焰色反应”的理解和应用不正确的是
A.可用光洁无锈的铁丝替代铂丝作焰色反应实验
B.实验完成后铂丝用盐酸洗净,在外焰上灼烧至没有颜色时再使用
C.只有某些金属或其化合物才有焰色反应
D.用焰色反应鉴别NaCl、KCl和K2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com