
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1)300℃时,该反应的平衡常数表达式为K=______________,已知K300℃<K350℃,则ΔH____0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率________(填“增大”“减小”或“不变”)。
科目:高中化学 来源: 题型:
【题目】下列物质中所含分子物质的量最多的是
A. 44 g CO2 B. 1.5 mol H2
C. 64 g SO2 D. 3.01×1023个硫酸分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺可以用以下三个反应合成:CaO+3C=CaC2+CO↑,CaC2+N2=CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排
布式:_____________________________________________。
CaCN2中阴离子为CN![]() ,与CN
,与CN![]() 互为等电子体的分子有________(填两种化学式),由此可以推知CN
互为等电子体的分子有________(填两种化学式),由此可以推知CN![]() 的空间构型为________,画出CN
的空间构型为________,画出CN![]() 电子式___________。
电子式___________。
(2)尿素分子中C原子采取________杂化。尿素分子的结构简式是________。
(3)三聚氰胺(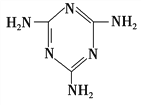 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(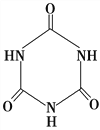 )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
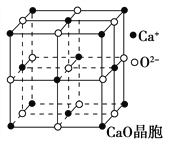
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________。CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关常见的几种金属氧化物的性质和用途的说法不正确的是( )
A. 氧化钙可用作干燥剂 B. Fe2O3可用于制作红色油漆和涂料
C. Al2O3可用作耐火材料 D. Na2O2、CuO、FeO都能溶于水,且与水反应都生成相应的碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是( )
A. 向氢氧化钾溶液中滴加少量氯化铝溶液Al3++4OH-=AlO2-+2 H2O
B. 向(NH4)2SO4溶液中加入足量Ba(OH)2:Ba2++SO42-=BaSO4↓
C. 碳酸氢钠溶液中加入过量氢氧化钠溶液 HCO3- + OH- =CO32- + H2O
D. 向浓硝酸中加入铜片:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. 浓硫酸具有脱水性,可用于干燥气体
B. FeCl3溶液水解呈酸性,可用作铜制线路板的蚀刻剂
C. 铜比铝活动性弱,可用铜罐代替铝罐贮运浓硝酸
D. ClO2具有强氧化性,可用于消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在容积为10L固定的密闭容器中充入4molNH3和5molO2发生如下反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),5s后,达到平衡并生成1molNO时:
4NO(g)+6H2O(g),5s后,达到平衡并生成1molNO时:
(1)O2的转化率为__________________。
(2)下列能说明该反应已经达到平衡状态的是____________。(填字母选项)
A.容器中气体总质量不变 B.c(O2)不变
C.5v(O2)正 = 4v(NO)逆 D.体系压强不变
(3)降低容器的温度则反应速率______,向该容器中通入Ar,则反应速率_______(选填“增大”、“减小”、“不变”)。
(4)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是________。(填字母选项)。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢
(5)已知对于可逆化学反应mA + nB ![]() pC + qD在一定温度下达到化学平衡时,其平衡常数K的表达式为:
pC + qD在一定温度下达到化学平衡时,其平衡常数K的表达式为:![]() (其中,C为各物质的平衡浓度),则该温度下,上述反应的平衡常数K = ___________________________(用数据表达,列出式子即可)。
(其中,C为各物质的平衡浓度),则该温度下,上述反应的平衡常数K = ___________________________(用数据表达,列出式子即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com