
【题目】Ⅰ、铁能形成多种价态的化合物,单质铁能被众多的氧化剂所氧化。
(1)将5.6g的生铁与足量的稀盐酸反应,生成H2的质量______0.2g(填“>”“<”“=”),向此生铁上滴加几滴稀硝酸,写出反应的离子方程式:___________________________。
(2)配制FeCl3溶液时常会出现浑浊现象,其原因是______________________(用离子方程式表示)。室温下配制5mol/L 200mL FeCl3溶液,至少需要添加_______mL 2mol/L的盐酸才会不出现浑浊(已知室温时Ksp[Fe(OH)3]=4.0×10-38,忽略加入盐酸对溶液体积的影响)。
(3)钢铁制品易生锈,导致其生锈的最主要原因是发生了________腐蚀;用NaOH、NaNO2等溶液对铁制品进行钝化处理可提高其抗腐蚀能力,下面是处理过程中所发生的一个反应:____Na2FeO2+_____NaNO2+_____H2O===_____Na2Fe2O4+_____NH3↑+_____,请完善该反应方程式。
II、硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为
NO2(g)+SO2(g)![]() SO3(g)+NO(g)△H=-41.8kJ·mol-1
SO3(g)+NO(g)△H=-41.8kJ·mol-1
(1)下列说法中可以说明该反应已达到平衡状态的是_________。
a. 体系内混合气体的密度保持不变 b. ![]()
c. 容器内气体的总压强保持不变 d. NO体积分数不再改变
(2)某温度下,NO2(g)+SO2(g)![]() SO3(g)+NO(g)的平衡常数k=2.25,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示。
SO3(g)+NO(g)的平衡常数k=2.25,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示。
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol/L | 0.10 | 0.20 | 0.20 |
c(SO2)/mol/L | 0.10 | 0.10 | 0.20 |
①10min后,甲中达到平衡,则甲中反应的平均速率![]() ___________。
___________。
②丙达到平衡所用的时间_________(填“<”“>”“=”)10min,达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为_________。
【答案】 < ![]() Fe3++3H2O
Fe3++3H2O![]() Fe(OH)3+3H+ 5 吸氧 6、1、5、3、1、7 NaOH bd 0.006mol/(L.min) < a=c<b
Fe(OH)3+3H+ 5 吸氧 6、1、5、3、1、7 NaOH bd 0.006mol/(L.min) < a=c<b
【解析】Ⅰ、(1)将5.6g的生铁与足量的稀盐酸反应,因生铁中含有碳,实际Fe的质量小于5.6g,则生成H2的质量<0.2g;过量铁溶解于少量稀硝酸生成硝酸亚铁和NO,此反应的离子方程式为 ;3Fe+8H++2NO3- =3Fe2++2NO↑+4H2O;
(2)因Fe3+易水解,水解反应式为Fe3++3H2O![]() Fe(OH)3+3H+,则配制FeCl3溶液时常会出现浑浊现象;若不出现浑浊现象,则c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有关数据后可求出c(OH-)≤2×10-13mol/L,c(H+)≥0.05mol/L,则加入盐酸的体积至少为
Fe(OH)3+3H+,则配制FeCl3溶液时常会出现浑浊现象;若不出现浑浊现象,则c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有关数据后可求出c(OH-)≤2×10-13mol/L,c(H+)≥0.05mol/L,则加入盐酸的体积至少为![]() =0.005L=5mL;
=0.005L=5mL;
(3)钢铁是合金,易发生吸氧腐蚀;在此氧化还原反应中,Na2FeO2化合价由+2价升为Na2Fe2O4的+3价,当2molNa2FeO2参与反应时,失去2mol电子;NaNO2做氧化剂,化合价由+3价将为NH3的-3价,当1molNaNO2参与反应时,失去6mol电子,根据得失电子数守恒可知,Na2FeO2的计量数为6,Na2Fe2O4的计量数为3,NaNO2的计量数为1,NH3的计量数为1,然后根据质量守恒可知,H2O的计量数为5,NaOH的计量数为7,反应为6Na2FeO2+NaNO2+5H2O═3Na2Fe2O4+NH3↑+7NaOH;
II、(1)a.混合气体的质量和体积不变,密度始终不变,无法判断是平衡状态,故a错误;b. ![]() 是平衡状态,故b正确;c.混合气体的总物质的量不变,体积不变,容器内压强始终不变,无法判断是平衡状态,故c错误;d.NO体积分数不再改变,量不变,是平衡状态,故d正确;答案为bd;
是平衡状态,故b正确;c.混合气体的总物质的量不变,体积不变,容器内压强始终不变,无法判断是平衡状态,故c错误;d.NO体积分数不再改变,量不变,是平衡状态,故d正确;答案为bd;
(2)①根据反应中NO2(g)和SO2(g)的起始浓度分别为0.1mol/L,设在10min达到平衡时,NO2浓度的该变量为x,根据三段式可知:
NO2(g)+SO2(g)SO3(g)+NO(g)
初始(mol/L):0.10.1 00
△C:x xxx
平衡:0.1-x0.1-x x x
根据平衡常数为![]() 可知:
可知: ![]() =
=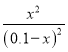 解得x=0.06mol/L.
解得x=0.06mol/L.
则平均速率v(NO2)= ![]() =0.006mol/(Lmin);
=0.006mol/(Lmin);
②由于容器体积相同,且反应为气体体积不变的反应,故按照等比加料,达到的是等效平衡,故甲和丙为等效平衡,即丙中所达的平衡状态和甲相同,而由于丙中反应物的浓度大于甲,故反应速率比甲快,到达平衡的时间比10min短;由于甲和丙为等效平衡,故甲、丙中SO2(g)的转化率相等,而乙相当于是向甲容器中加入NO2,据故SO2的转化率大于甲,故三个容器中的转化率的关系为a=c<b。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A. NA个Fe(OH)3胶体粒子的质量为107 g
B. 12g金刚石含有4NAσ键
C. 14 g分子式为CnH2n的链烃中含有的π键的数目为NA/n
D. 1 mol冰醋酸和1 mol乙醇经酯化反应可生成H2O分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关常见的几种金属氧化物的性质和用途的说法不正确的是( )
A. 氧化钙可用作干燥剂 B. Fe2O3可用于制作红色油漆和涂料
C. Al2O3可用作耐火材料 D. Na2O2、CuO、FeO都能溶于水,且与水反应都生成相应的碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是( )
A. 向氢氧化钾溶液中滴加少量氯化铝溶液Al3++4OH-=AlO2-+2 H2O
B. 向(NH4)2SO4溶液中加入足量Ba(OH)2:Ba2++SO42-=BaSO4↓
C. 碳酸氢钠溶液中加入过量氢氧化钠溶液 HCO3- + OH- =CO32- + H2O
D. 向浓硝酸中加入铜片:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. 浓硫酸具有脱水性,可用于干燥气体
B. FeCl3溶液水解呈酸性,可用作铜制线路板的蚀刻剂
C. 铜比铝活动性弱,可用铜罐代替铝罐贮运浓硝酸
D. ClO2具有强氧化性,可用于消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺铂[Pt(NH3)2Cl2]是1969年发现的第一种具有抗癌活性的金属配合物;碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,结构简式如图所示,其毒副作用低于顺铂。下列说法正确的是( )

A. 碳铂中所有碳原子在同一个平面中
B. 顺铂分子中氮原子的杂化方式是sp2
C. 碳铂分子中sp3杂化的碳原子与sp2杂化的碳原子之比为2∶1
D. 1 mol 1,1-环丁二羧酸含有σ键的数目为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在容积为10L固定的密闭容器中充入4molNH3和5molO2发生如下反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),5s后,达到平衡并生成1molNO时:
4NO(g)+6H2O(g),5s后,达到平衡并生成1molNO时:
(1)O2的转化率为__________________。
(2)下列能说明该反应已经达到平衡状态的是____________。(填字母选项)
A.容器中气体总质量不变 B.c(O2)不变
C.5v(O2)正 = 4v(NO)逆 D.体系压强不变
(3)降低容器的温度则反应速率______,向该容器中通入Ar,则反应速率_______(选填“增大”、“减小”、“不变”)。
(4)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是________。(填字母选项)。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢
(5)已知对于可逆化学反应mA + nB ![]() pC + qD在一定温度下达到化学平衡时,其平衡常数K的表达式为:
pC + qD在一定温度下达到化学平衡时,其平衡常数K的表达式为:![]() (其中,C为各物质的平衡浓度),则该温度下,上述反应的平衡常数K = ___________________________(用数据表达,列出式子即可)。
(其中,C为各物质的平衡浓度),则该温度下,上述反应的平衡常数K = ___________________________(用数据表达,列出式子即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Na2CO3溶液中CO32-水解:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. Fe3O4溶于稀HNO3:3Fe3O4+28H++NO3- = 9Fe3++NO↑+14H2O
C. 少量的SO2通入NaClO溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+
D. 向含Ba(OH)2和KOH均为0.1mol的混合溶液中通入标准状况下4.48LCO2气体:Ba2++3OH-+2CO2=BaCO3↓+HCO3-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 18克的D216O中含有的中子数为9NA
B. 标准状况下,22.4LSO3含有的原子数为4NA
C. 80ml10mol/L盐酸与足量MnO2加热反应,产生的Cl2分子数为0.2NA
D. 精炼铜过程中,阳极质量减少6.4g时,电路中转移电子为0.2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com