
| A、温度过高致少量碳酸钠分解了 |
| B、碳酸钠晶体样品已有少量风化 |
| C、样品加热后放在干燥器中进行冷却 |
| D、加热过程中有少量晶体溅出 |


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
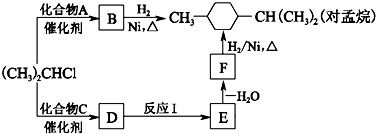
 (R为烷基,X为卤素原子)②RCH2CH2OH
(R为烷基,X为卤素原子)②RCH2CH2OH| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、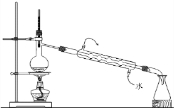 用如图装置进行蒸馏实验 用如图装置进行蒸馏实验 |
B、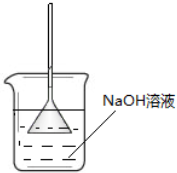 用如图装置吸收氯化氢气体 用如图装置吸收氯化氢气体 |
C、 用酒精提取溴水中的溴 用酒精提取溴水中的溴 |
D、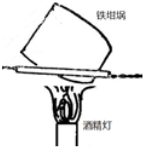 用如图装置灼烧小苏打制取少量的苏打 用如图装置灼烧小苏打制取少量的苏打 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com