
ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȼ���ֵ�����⣮��֪��CO��g��+H2O��g�� H2��g��+CO2��g��ƽ�ⳣ�����¶ȵı仯���±���
H2��g��+CO2��g��ƽ�ⳣ�����¶ȵı仯���±���
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
�Իش��������⣺
��1����800�淢��������Ӧ���Ա��е����ʵ���Ͷ����ݷ�Ӧ��������������Ӧ�����ƶ����� ��ѡ��A��B��C��D��E����
| n��CO�� | n��H2O�� | n��H2�� | n��CO2�� |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 2 | 1 | 2 | 3 |
D | 0.5 | 2 | 1 | 1 |
E | 3 | 1 | 2 | 1 |
��2����1L�ܱ�������ͨ��10 molCO��10 molˮ����,��500���¾���30s�ﵽƽ��,��30s��CO��ƽ����Ӧ����Ϊ
��3����֪��һ���¶��£�C��s��+CO2��g�� 2CO��g��ƽ�ⳣ��K��K�ı���ʽ ��C��s��+H2O��g��
2CO��g��ƽ�ⳣ��K��K�ı���ʽ ��C��s��+H2O��g�� CO��g��+ H2��g��ƽ�ⳣ��K1�� CO��g��+H2O��g��
CO��g��+ H2��g��ƽ�ⳣ��K1�� CO��g��+H2O��g�� H2��g��+ CO2��g��ƽ�ⳣ��K2����K��K1��K2֮��Ĺ�ϵ�ǣ�
H2��g��+ CO2��g��ƽ�ⳣ��K2����K��K1��K2֮��Ĺ�ϵ�ǣ�
��4��ij�¶ȡ��ݻ��̶������У�Ͷ��һ����Ӧ��Կ��淴ӦC��s��+ CO2��g�� 2CO��g�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����
2CO��g�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����
A��c��CO2��= c��CO��
B�����������Է�����������
C�������е�ѹǿ����
D��v����CO��= 2v����CO2��
E.c��CO�����ֲ���
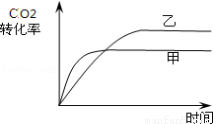
��5����ͼ1��ʾ���ڼס����������ж�����1mol C��1mol CO2����ʹ�ס�����������ʼ�ݻ����.����ͬ�¶��·�����ӦC(s)+CO2(g)  2CO(g)����ά�ַ�Ӧ�������¶Ȳ��䣮��֪��������CO2��ת������ʱ��仯��ͼ����ͼ2��ʾ,����ͼ2�л�����������CO2��ת������ʱ��仯��ͼ��
2CO(g)����ά�ַ�Ӧ�������¶Ȳ��䣮��֪��������CO2��ת������ʱ��仯��ͼ����ͼ2��ʾ,����ͼ2�л�����������CO2��ת������ʱ��仯��ͼ��

1.BE 2.0.25mol?L��1?s��1 3. K=
K= 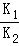 4.AD 5.
4.AD 5.
��������
�����������1���ɱ���֪���¶�Խ�ߣ�ƽ�ⳣ��ԽС����Ӧ���г̶�ԽС��ƽ�����淴Ӧ�ƶ��������¶�ƽ�������ȷ����ƶ���������ӦΪ���ȷ�Ӧ����Ӧ��ͬһ�����ڽ��У������ͬ������ʽ�и����ʵĻ�ѧ����������1�������ڼ����о��������ʵ�����ֵ����Ũ����ֵ��800��ʱ��Ӧƽ�ⳣ��Ϊ1��k=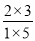 =
=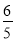 ������1����Ӧ���淴Ӧ���У���A����k=
������1����Ӧ���淴Ӧ���У���A����k=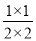 =
=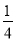 ��С��1����Ӧ������Ӧ���У���B��ȷ����ʼֻ��CO��H2����Ӧ������Ӧ���У���C��ȷ��D��k=
��С��1����Ӧ������Ӧ���У���B��ȷ����ʼֻ��CO��H2����Ӧ������Ӧ���У���C��ȷ��D��k= =1������ƽ��״̬����D����k=
=1������ƽ��״̬����D����k= =
=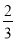 ��С��1����Ӧ������Ӧ���У���E��ȷ����2����ƽ��ʱ��������Ũ��Ϊxmol/L���������̼��Ũ��Ϊxmol/L��һ����̼��ˮ������Ũ��Ϊ��10-x��mol/L����k=
��С��1����Ӧ������Ӧ���У���E��ȷ����2����ƽ��ʱ��������Ũ��Ϊxmol/L���������̼��Ũ��Ϊxmol/L��һ����̼��ˮ������Ũ��Ϊ��10-x��mol/L����k= =9��x=7.5���μӷ�Ӧ��һ����̼��Ũ��Ϊ��7.5mol/L����30s��CO��ƽ����Ӧ����Ϊ
=9��x=7.5���μӷ�Ӧ��һ����̼��Ũ��Ϊ��7.5mol/L����30s��CO��ƽ����Ӧ����Ϊ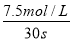 =0.25mol/��L?S������3����Ӧ��C��s��+CO2��g��
=0.25mol/��L?S������3����Ӧ��C��s��+CO2��g��  2CO��g��ƽ�ⳣ��K=
2CO��g��ƽ�ⳣ��K=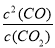 ����Ӧ��C��s��+H2O��g��
����Ӧ��C��s��+H2O��g��  CO��g��+H2��g��ƽ�ⳣ��K1=
CO��g��+H2��g��ƽ�ⳣ��K1=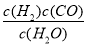 ����Ӧ��CO��g��+H2O��g��
����Ӧ��CO��g��+H2O��g�� H2��g��+CO2��g�� ƽ�ⳣ��K2=
H2��g��+CO2��g�� ƽ�ⳣ��K2=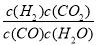 ����Ӧ��-��Ӧ�۵÷�Ӧ�٣�����K=
����Ӧ��-��Ӧ�۵÷�Ӧ�٣�����K=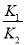 ����4��c��CO2��=c��CO�������жϻ�ѧƽ��״̬������ʼ���йأ���A�����������Է����������䣬����Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ���B��ȷ���÷�ӦΪ��Ӧǰ������������ȵķ�Ӧ���������е�ѹǿ�������Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ���C��ȷ�� v����CO��=2v����CO2����������Ϊƽ��״̬���оݣ���D����c��CO�����ֲ��䣬����Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ���E��ȷ����5��C��s��+CO2��g��
����4��c��CO2��=c��CO�������жϻ�ѧƽ��״̬������ʼ���йأ���A�����������Է����������䣬����Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ���B��ȷ���÷�ӦΪ��Ӧǰ������������ȵķ�Ӧ���������е�ѹǿ�������Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ���C��ȷ�� v����CO��=2v����CO2����������Ϊƽ��״̬���оݣ���D����c��CO�����ֲ��䣬����Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ���E��ȷ����5��C��s��+CO2��g��  2CO��g�������ŷ�Ӧ�Ľ��У�����ѹǿ���������Ǻ�ѹ����������ڼ��ԣ��൱�ڼ�Сѹǿ��ƽ�������ƶ�����ѧ��Ӧ���ʼ�����������̼��ת����������������CO2��ת������ʱ��仯��ͼ��Ϊ��
2CO��g�������ŷ�Ӧ�Ľ��У�����ѹǿ���������Ǻ�ѹ����������ڼ��ԣ��൱�ڼ�Сѹǿ��ƽ�������ƶ�����ѧ��Ӧ���ʼ�����������̼��ת����������������CO2��ת������ʱ��仯��ͼ��Ϊ��
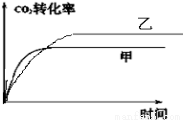
���㣺��ѧƽ���Ӱ����������Ӧ���ʵĶ�����ʾ��������ѧƽ�ⳣ���ĺ�������ѧƽ��״̬���ж���ת�������¶ȡ�ѹǿ�ı仯����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ����������и߶���ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ij���ṹʽ�ü���ʽ��ʾΪ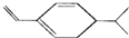 �� ������Br2�ӳ�ʱ����
�� ������Br2�ӳ�ʱ����
�ʵ���֮��Ϊ1��1�������ò�����
A��3�� B��4�� C��5�� D��6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ����������и�һ��ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������100ml 1.0 mol��L��1Na2SO4��Һ����ȷ�ķ�����( )
�� ��14.2 g Na2SO4 ����100mlˮ��
�� ��32.2g Na2SO4��10H2O��������ˮ�У�����ˮϡ����100 ml
�� ��20 ml 5.0 mol/L Na2SO4��Һ��ˮϡ����100 ml
A���٢� B���ڢ� C�� �� D���٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ����������и�һ��ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾ������ƿ�Ŀ̶��߱��ڱȽ�ϸ��ƿ��֮�ϡ�������ijͬѧ�²������������ԭ������Ϊ��ȷ���� ( )

A��Ϊ������ B��Ϊ��ͳһ�� C��Ϊ�����ȷ�� D������̻�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ����������и߶��ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ�������£����淴ӦX(g) + 3Y(g) 2Z(g)�ﵽƽ��ʱ�����Y��ת����Ϊ37.5%��X��ת����Ϊ25%����Ӧ��ʼʱ�����������е�X��Y�����ʵ���֮���ǣ�
2Z(g)�ﵽƽ��ʱ�����Y��ת����Ϊ37.5%��X��ת����Ϊ25%����Ӧ��ʼʱ�����������е�X��Y�����ʵ���֮���ǣ�
A��1:3 B��3:1 C��3:2 D��1:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ����������и߶��ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A��ͬ��ͬѹ��,H2(g)+Cl2(g)��2HCl(g)�ڹ��պ͵�ȼ�����µĦ�H��ͬ
B��������,2A(s)+B(g)��2C(g)+D(g)�����Է�����,�÷�Ӧ�ʱ�һ��������
C��1mol������1molBa(OH)2��ȫ�к����ų�������Ϊ�к���
D����25�桢101KPaʱ��2mol S��ȼ������1mol S��2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�߶���ѧ�����п����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A��һ�����淴Ӧ�ﵽ��ƽ��״̬���������Ӧ�ڸ����������ܴﵽ����
B�������£���Mg��OH��2������Һ�м���NaOH��Һ��Mg��OH��2��Ksp����
C�����С����š���ͭпԭ��رȲ��������š���ͭпԭ��ص�������ʱ�䳤
D���Եμӷ�̪��NaHCO3��Һ���ȣ���ɫ�������Ϊ����ʱNaHCO3�ֽ�����Na2CO3��������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
25��ʱ�������й���Һ���������ʵ���Ũ�ȹ�ϵ�������
A��0��1mol/LCH3COONa��0��1mol/LHCl��Һ�������ϣ�c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B��0��1mol/LNH4Cl��0��1mol/L��ˮ��Һ�������ϣ�c(NH3��H2O)>c(NH4+)>c(Cl-)>c(OH-)
C��0��1mol/LNa2CO3��0��1mol/LNaHCO3��Һ�������ϣ�2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
D��Na2C2O4��Һ��HCl��Һ��������(H2C2O4�Ƕ�Ԫ����)��2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com