
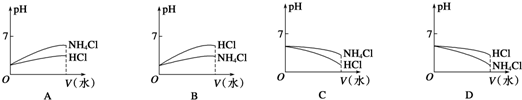
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| 7.0×10-9 |
| (0.5×10-2)2 |
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| 0.05×10-7 |
| 0.5a-0.05 |
| 10-8 |
| a-0.1 |
| 10-8 |
| a-0.1 |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、平衡常数的表达式K=
| ||
| B、当v正(NH3):v正(NO)=1:1时,说明该反应已经达到平衡 | ||
| C、若平衡时两种反应物的转化率相等,则起始投入的n(NH3):n(O2)=5:4 | ||
| D、反应达到平衡后,恒容条件下,同倍数改变NH3和NO的量,c(O2)=可能不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
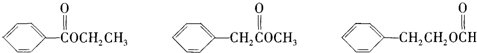
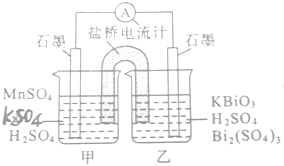
查看答案和解析>>
科目:高中化学 来源: 题型:
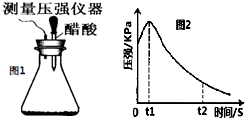 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 0.5 | 2.0 | 36.0 | |
| ③ | 碳粉质量的影响 | 0.2 | 2.0 | 90.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

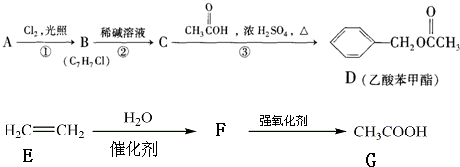
查看答案和解析>>
科目:高中化学 来源: 题型:
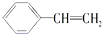 的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )
的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )| A、①②④ | B、①②④⑥ |
| C、①②④⑤⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com