
【题目】用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH (不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为( )
A. 0.4 molB. 0.5 molC. 0.6 molD. 0.8 mol
【答案】C
【解析】
根据电解硫酸铜的原理:第一阶段:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,第二阶段:2H2O
2Cu+O2↑+2H2SO4,第二阶段:2H2O![]() 2H2↑+O2↑,根据所加入的Cu2(OH)2CO3的量根据电极反应来计算即可。
2H2↑+O2↑,根据所加入的Cu2(OH)2CO3的量根据电极反应来计算即可。
电解硫酸铜时,初阶段:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,后阶段:2H2O
2Cu+O2↑+2H2SO4,后阶段:2H2O![]() 2H2↑+O2↑,如果只按照第一阶段的电解,反应只需要加入CuO或CuCO3就可以,但是现在加入的是Cu2(OH)2CO3,相当于多加入了一个水(0.1molH2O),这0.1mol的水,应该是第二阶段的反应进行,该阶段转移了0.2mol电子,第一阶段转移了0.4mol电子,所以总共转移电子0.6mol,故C正确;
2H2↑+O2↑,如果只按照第一阶段的电解,反应只需要加入CuO或CuCO3就可以,但是现在加入的是Cu2(OH)2CO3,相当于多加入了一个水(0.1molH2O),这0.1mol的水,应该是第二阶段的反应进行,该阶段转移了0.2mol电子,第一阶段转移了0.4mol电子,所以总共转移电子0.6mol,故C正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】用60 g乙酸和46 g乙醇反应,如果实际产率是理论产率的一半,则可得到的乙酸乙酯的质量是( )
A. 29.5gB. 44 gC. 74.8 gD. 88 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,A元素的一种单质是自然界最硬的物质,B为最活泼的非金属元素,C元素的原子的电子层数是最外层电子数的3倍,D元素最高化合价为+6价。
(1)D在周期表中的位置是 _____________,E的离子结构示意图_____________;
(2)C与D 形成化合物的电子式为_____________;
(3)A、D、E三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是______;
(4)由B、C、D形成的简单离子半径由大到小的顺序是________________;
(5)B形成的氢化物沸点比E形成的氢化物沸点_______(填“高”或“低”),原因是___________;
(6)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂.该物质的摩尔质量为146g/mol,该物质的化学式为____。已知DBn在温度高于45°时为气态,DBn属于____晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )
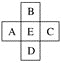
A. 4xB. 4x+14
C. 4x+10D. 4x+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是( )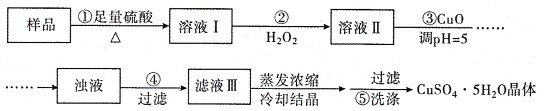
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 滤液Ⅲ中无Fe3+,在后面的结晶过程中不会析出Fe2(SO4)3造成产品不纯,因此可直接用蒸发结晶的方法得到胆矾晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的_________是溶液变绿的原因,写出产生该物质的电极反应式:_________________________。
(2)乙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色; |
乙通过对现象分析证实了甲的观点不是溶液变绿的主要原因。乙否定甲的依据是______________。
(3)乙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]--,[CuCl2]- 掺杂Cu2+ 后呈黄色
ii. 稀释含[CuCl2]- 的溶液生成CuCl白色沉淀,据此乙认为:电解过程中,产生[CuCl2]_掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
乙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]_的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是__________________________________________。
② 写出b中生成[CuCl2]- 的离子方程式:____________________________________________。
③ 补充c中必要的操作及现象:____________________________________________。
乙据此得出结论:电解时阴极附近生成[CuCl2]- 是导致溶液变绿的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。例如,

该反应式也可表示为

下面是几种有机化合物的转化关系:

(1)根据系统命名法,化合物A的名称是_____________。
(2)上述框图中,①_________是反应,③___________是反应。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:_________。
(4)C2的结构简式是,F1的结构简式是______________,F1与F2互为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的生成物Y的浓度在4min内由0变成了4mol/L,则以Y表示该反应在4min内的平均反应速率为 ( )
A. 16 mol/(L·min) B. 4 mol/(L·min)
C. 2 mol/(L·min) D. 1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在生产生活中有广泛的应用。下列叙述正确的是
A.开发新技术可将水分解成氢气、氧气并释放能量
B.研制新型催化剂可提高汽车尾气的平衡转化率
C.燃料电池能将化学能完全转化为电能
D.为防止金属管道被腐蚀,应将金属管道与电源负极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com