
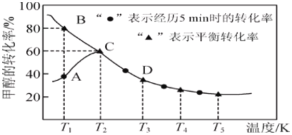
【题目】工业上主要采用甲醇与CO的羰基化反应来制备乙酸,发生反应如下:CH3OH(g)+CO(g)=CH3COOH(l)。在恒压密闭容器中通入0.20mol的CH3OH(g)和0.22mol的CO,测得甲醇的转化率随温度变化如图所示。已知在T2温度下,达到平衡时容器的体积为2L。下列说法正确的是( )
A.该反应的ΔH>0
B.缩小容器容积,既能加快反应速率,又能提高乙酸的产率
C.温度为T1时,该反应的正反应速率:B点大于A点
D.温度为T2时,向上述已达到平衡的恒压容器中,再通入0.12molCH3OH和0.06molCO的混合气体,平衡不移动
【答案】BD
【解析】
A. 根据图像,随着温度升高甲醇的平衡转化率降低,平衡向逆反应方向进行,根据勒夏特列原理,该反应的正反应为放热反应,即△H<0,故A错误;
B. 缩小容器的体积,相当于增大体系压强,反应速率加快,且平衡正向移动,乙酸的产率提高,故B说法正确;
C. 根据图像,T1温度下未达到平衡,反应向正方向进行,该反应的正反应速率:A点大于B点,故C说法错误;
D. T2下,甲醇的转化率为60%,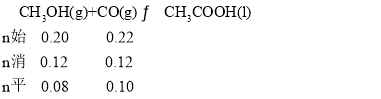 ,达到平衡,此时容器的体积为2L,c(CH3OH)=0.04mol·L-1,c(CO)=0.05mol·L-1,化学平衡常数K=
,达到平衡,此时容器的体积为2L,c(CH3OH)=0.04mol·L-1,c(CO)=0.05mol·L-1,化学平衡常数K=![]() =500,再充入0.12molCH3OH和0.06molCO,此时气体总物质的量与原平衡时气体总物质的量相等,即容器的体积为4L,此时c(CH3OH)=
=500,再充入0.12molCH3OH和0.06molCO,此时气体总物质的量与原平衡时气体总物质的量相等,即容器的体积为4L,此时c(CH3OH)=![]() =0.05mol·L-1,c(CO)=
=0.05mol·L-1,c(CO)=![]() =0.04mol·L-1,Qc=
=0.04mol·L-1,Qc=![]() =K,说明平衡不移动,故D说法正确;
=K,说明平衡不移动,故D说法正确;
答案:BD。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是
A.1 L0.1 mol·L-1NaClO溶液中,阳离子数目为0.1NA
B.1molFe与32gS充分反应,转移的电子数目为2NA
C.1.12 L由NO2和CO2组成的混合气体中含氧原子数目为0.1NA
D.1molN2与足量的H2充分反应,生成N—H键的数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢噻吩(![]() )是家用天然气中人工添加的气味添加剂具有相当程度的臭味。下列关于该化合物的说法正确的是( )
)是家用天然气中人工添加的气味添加剂具有相当程度的臭味。下列关于该化合物的说法正确的是( )
A.不能在O2中燃烧
B.![]() 所有原子可能共平面
所有原子可能共平面
C.![]() 与Br2的加成产物只有一种
与Br2的加成产物只有一种
D.生成1molC4H9SH至少需要2molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略)如图所示:
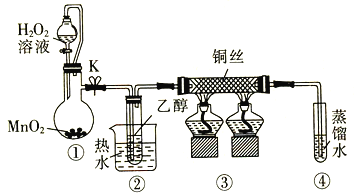
下列说法错误的是
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为2CH3CH2OH +O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出。再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于室温下下列溶液的说法不正确的是( )
编号 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氢氧化钠溶液 | 盐酸 | 醋酸溶液 |
pH | 11 | 11 | 3 | 3 |
A. 水的电离程度:①=②=③=④
B. 分别加水稀释10倍,溶液的pH:①>②>③>④
C. ①③两溶液等体积混合:c(Cl-)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D. V1 L溶液②与V2 L溶液③混合,若V1∶V2=9∶11,则混合溶液pH=4(忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() )。下列说法错误的是
)。下列说法错误的是
A. 肉桂醛和苯甲醛互为同系物
B. 肉桂醛能发生加成反应、取代反应和加聚反应
C. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
D. 1mol肉桂醛分子在一定条件下最多与5mol氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0. 100mol·L-1的NaOH溶液分别滴定10.00mL浓度均为0.100mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
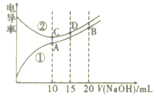
A.曲线②代表滴定CH3COOH溶液的曲线
B.在相同温度下,C、D两点溶液中水的电离程度: C>D
C.取A点溶液1mL加水稀释,溶液中的所有离子浓度都减小
D.B点溶液中: c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸甲酯催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为: CH3COOCH3(l) +C6H13OH (l) ![]() CH3COOC6H13(l) +CH3OH(l)
CH3COOC6H13(l) +CH3OH(l)
反应开始时,己醇和乙酸甲酯按物质的量之比 1:1 投料,测得 348 K、343 K 两个温度 下乙酸甲酯转化率(α)随时间(t)的变化关系如下图所示:
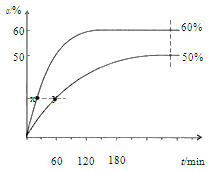
下列说法不正确的是
A.该醇解反应的ΔH > 0
B.反应速率:v(x)> v(y)
C.343K时,以物质的量分数表示的化学平衡常数 Kx=2.25
D.348K时,初始投料![]() 分别按 1:1和2:1进行,Kx 相同
分别按 1:1和2:1进行,Kx 相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com