
【题目】绿色化学的核心就是利用化学原理从源头上减少或消除工业生产对环境的污染。下列属于绿色化学的是
A. 氢能源代替化石能源 B. 污水的治理
C. 废弃塑料的回收和利用 D. 焚烧“白色污染”物
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,其溶解度约是Cl2的5倍,但温度过高、浓度过大时均易发生分解,因此常将其制成固体,以便运输和贮存。制备KClO2固体的实验裝置如图所示,其中A装置制备ClO2,B装置制备KClO2。请回答下列问题:
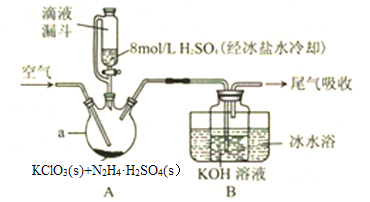
(1)仪器a的名称是________。
(2)滴液漏斗与普通分液漏斗相比,其优点是_________。
(3)加入的硫酸需要用冰盐水冷却的原因是_________。
(4)实验过程中通入空气的目的是________,空气流速过快或过慢,均降低KClO2产率,试解释其原因________ 。
(5)用图示装置制备的KClO2中含有较多杂质,其原因是________。
(6)A中制备ClO2的化学方程式为_________ 。
(7)有人认为用图示装置吸收ClO2易引起倒吸,但经过多次实验均未发现有倒吸现象,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
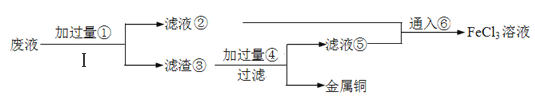
(1)步骤Ⅰ的操作名称:________;所需玻璃仪器:_________、_________、__________。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:______________________。
(3)检验废腐蚀液中是否含有Fe3+所需试剂名称:___________、实验现象:__________。
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:________________,此转化的化学方程式为:______________________________。
(5)写出③中所含物质:_________⑥发生反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥法表示下列反应的电子转移情况并将其改写成离子方程式: 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,______________,离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图所示为常见玻璃仪器的部分结构:
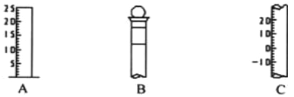
(1)请写出所列仪器的名称: A______,B_______,C_______;
(2)仪器 B 使用前必须__________________。
(3)仪器 B 上标记有______(填序号);①质量 ②温度 ③刻度线 ④浓度 ⑤容积
II.已知某“84 消毒液”瓶体部分标签如图所示,该“84 消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:
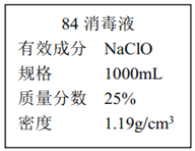
(1)该“84 消毒液”的物质的量浓度约为_______mol·L-1。(保留两位有效数字)
(2)某同学取100 mL该“84 消毒液”,稀释后用于消毒,稀释后的溶液中 c (Na+)=_____。
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 250 mL含 NaClO 质量分数为 25%的消毒液。下列说法不正确的是________(填序号)。
a.如图所示的仪器中,有三种是不需要的,还需要其它玻璃仪器
b.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
(4) “84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为1.84g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1 的稀硫酸用于增强“84 消毒液”的消毒能力。需用浓硫酸的体积为______ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为酸性介质中,金属铜与氢叠氮酸(HN3) 构成的原电池,总反应方程式为: 2Cu+2Cl-+HN3+3H+=2CuCl(s)+N2↑+NH4+。下列叙述错误的是( )
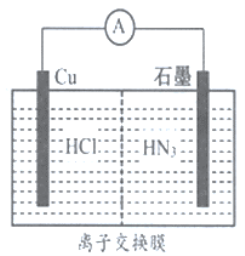
A. 离子交换膜为阳离子交换膜
B. 若将盐酸换成NaCl,电池的运行效率将会下降
C. 负极的电极反应式为:Cu-e-=Cu+
D. 当外电路中流过0.1mol电子时,交换膜左侧离子减少0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POCl3是重要的基础化工原料,广泛用于制药、染料、表面活性剂等行业。一种制备POCl3的原理为:PCl3+Cl2+SO2=POCl3+SOCl2。某化学学习小组拟利用如下装置在实验室模拟制备POCl3。有关物质的部分性质如下:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其它 |
PCl3 | -93.6 | 76.1 | 1.574 | 遇水强烈水解,易与氧气反应 |
POCl3 | 1.25 | 105.8 | 1.645 | 遇水强烈水解,能溶于PCl3 |
SOCl2 | -105 | 78.8 | 1.638 | 遇水强烈水解,加热易分解 |

(1)仪器甲的名称为______________,与自来水进水管连接的接口编号是________________。(填“a”或“b”)。
(2)装置C的作用是___________________,乙中试剂的名称为____________________。
(3)该装置有一处缺陷,解决的方法是在现有装置中再添加一个装置,该装置中应装入的试剂为_________(写名称)。若无该装置,则可能会有什么后果?请用化学方程式进行说明__________________________。
(4)D中反应温度控制在60-65℃,其原因是_______________。
(5)测定POCl3含量。①准确称取30.70gPOCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;③加入10.00mL3.200mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;④以Fe3+为指示剂,用0.2000mol/LKSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
①滴定终点的现象为____________________,用硝基苯覆盖沉淀的目的是__________________。
②反应中POCl3的百分含量为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)常用作粮食熏蒸剂,制取反应为 CO(g)+H2S(g) ![]() COS(g)+H2(g),△H=-30kJ·mol-1。在恒容的密闭容器中不同条件下发生反应并达到平衡,数据如下表。
COS(g)+H2(g),△H=-30kJ·mol-1。在恒容的密闭容器中不同条件下发生反应并达到平衡,数据如下表。
实验 | 温度/℃ | n起始/mol | 平衡时 | 所需时间 | |||
CO | H2S | COS | H2 | n(CO)/mol | min | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 | e |
2 | 150 | 7.0 | 7.0 | 3.0 | 3.0 | a | f |
3 | 200 | 20.0 | 20.0 | 0 | 0 | 16.0 | g |
下列说法错误的是
A. 实验1 反应开始到平衡整个过程中放出的热量为 90kJ
B. 实验2 达平衡时,a>7.0
C. 实验3 时间:g<e
D. 实验3 CO 达到平衡时的转化率比实验1 小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com