
【题目】ClO2是一种优良的消毒剂,其溶解度约是Cl2的5倍,但温度过高、浓度过大时均易发生分解,因此常将其制成固体,以便运输和贮存。制备KClO2固体的实验裝置如图所示,其中A装置制备ClO2,B装置制备KClO2。请回答下列问题:
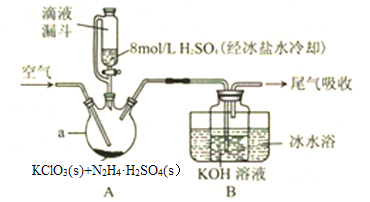
(1)仪器a的名称是________。
(2)滴液漏斗与普通分液漏斗相比,其优点是_________。
(3)加入的硫酸需要用冰盐水冷却的原因是_________。
(4)实验过程中通入空气的目的是________,空气流速过快或过慢,均降低KClO2产率,试解释其原因________ 。
(5)用图示装置制备的KClO2中含有较多杂质,其原因是________。
(6)A中制备ClO2的化学方程式为_________ 。
(7)有人认为用图示装置吸收ClO2易引起倒吸,但经过多次实验均未发现有倒吸现象,其原因是________。
【答案】 三颈烧瓶 滴液漏斗液面上方和三颈烧瓶液面上方气压相等,使液体能順利滴下 防止液体飞溅,防止生成的ClO2分解 将生成的ClO2全部赶出以被KOH吸收 空气流速过慢时,ClO2不能及时被移走,浓度过高会导致分解;空气流速过快吋,ClO2不能被充分吸收 生成KClO2的同吋必有ClO2的氧化产物KClO3或KClO4 4 KClO2+N2H4·H2SO4+H2SO4=4ClO2+N2↑+2K2SO4+4H2O(K2SO4写成KHSO4也可以) 生成ClO2的同时也产生N2,或有持续通入的空气流
【解析】(1)仪器a为反应的发生器,是三颈烧瓶;正确答案:三颈烧瓶。
(2)滴液漏斗与普通分液漏斗相比,其优点是滴液漏斗液面上方和三颈烧瓶液面上方气压相等,使液体能順利滴下;正确答案:滴液漏斗液面上方和三颈烧瓶液面上方气压相等,使液体能順利滴下。
(3)浓硫酸溶于水放出大量的热,会导致反应生成的ClO2分解,产率降低,同时也能防止浓硫酸稀释时液体飞溅;因此加入的硫酸需要用冰盐水冷却;正确答案:防止液体飞溅,防止生成的ClO2分解。
(4)实验过程中通入空气的目的是能够使反应产生的ClO2全部被氢氧化钾溶液吸收,提高ClO2的利用率,但如果空气流速过快或过慢,均降低KClO2产率;其原因是空气流速过慢时,ClO2不能及时被移走,浓度过高会导致分解;空气流速过快吋,ClO2不能被充分吸收;正确答案:将生成的ClO2全部赶出以被KOH吸收; 空气流速过慢时,ClO2不能及时被移走,浓度过高会导致分解;空气流速过快吋,ClO2不能被充分吸收。
(5)用图示装置制备的KClO2中含有较多杂质,根据氧化还原反应规律,ClO2与碱反应时,生成KClO2的同吋,必有ClO2的氧化产物KClO3或KClO4 生成;正确答案:生成KClO2的同吋必有ClO2的氧化产物KClO3或KClO4。
(6)根据题给信息可知:KClO2与N2H4·H2SO4在酸性条件下反应生成ClO2和氮气等物质,化学方程式为4KClO2+N2H4·H2SO4+H2SO4=4ClO2+N2↑+2K2SO4+4H2O;正确答案:4KClO2+N2H4·H2SO4+H2SO4=4ClO2+N2↑+2K2SO4+4H2O(K2SO4写成KHSO4也可以)。
(7)反应生成ClO2的同时,还产生N2,同时该反应过程中有持续通入的空气流,因此不能产生倒吸现象;正确答案:生成ClO2的同时也产生N2,或有持续通入的空气流。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A. 向Ba(OH)2溶液中滴加NaHSO4溶液至沉淀刚好完全:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2 H2O
B. AlCl3溶液中加入过量氨水:Al3++4OH-=== ![]() +2H2O
+2H2O
C. 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D. 澄清石灰水和碳酸钠溶液反应:Ca(OH)2+CO32-=CaCO3↓+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钪(Sc)及其化合物在电子、宇航、超导等方面有着广泛的应用。某工厂的钛白水解工业废酸中,Sc3+浓度为18mg/L,还含有大量的TiO2+、Fe3+、H+、SO42-等。下图为从该工业废酸中提取Sc2O3的一种流程。

回答下列问题:
(1)在钛白水解工业废酸中,加入双氧水是为了使TiO2+转化为难萃取的[Ti(O2)(OH(H2O)4]+。[Ti(O2)(OH(H2O)4]+中Ti的化合价为+4,其中非极性键的数目为_______。
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如左下图,应选择的最佳O/A值为_______;温度对钪、钛的萃取率影响情况见右下表,合适的萃取温度为10-15℃,其理由是_____________________。

(3)洗涤“油相“可除去大量的钛离子。洗染水是用浓硫酸、双氧水和水按一定比例混合而成。混合过程的实验操作为________________。
(4)25℃时,用氨水调节滤液的pH,当pH=3.5时,滤渣II的主要成分是_______;当pH=6时,滤液中Sc3+的浓度为________。(Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(5)写出用草酸(H2C2O4)“沉钪”得到Sc2(C2O4)3的离子方程式_____________。
(6)若从1m3该工厂的钛白水解度酸中提取得到24.4gSc2O3,则钪的提取率为______(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快的是
A. v(H2)=0.lmol /(L·min)
B. v(N2) =0.1mol /(L·min)
C. v(NH3)=0.15mol / (L·min)
D. v (N2)=0.02mol /(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质比较不正确的( )
A.热稳定性:HCl>HBr
B.沸点:H2O>H2S
C.碱性:Ca(OH)2>Mg(OH)2
D.酸性:H3PO4>H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
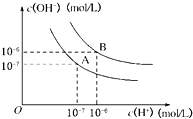
【题目】水的电离平衡曲线如图所示:
(1)若A点、B点分别表示25℃和100℃时水的电离平衡时离子的浓度,则表示25℃的是______(填“A”或“B”),100℃时水的离子积为__________。
(2)100℃,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液pH=7,则NaOH溶液与盐酸溶液的体积比为_____。
(3)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应离子方程式是2MnO4-+ 5HSO3- + H+=2Mn2+ + 5SO42- + 3H2O 填空回答问题:

①滴定时,将酸性KMnO4标准液装在图中的___________ (填“甲”或“乙”) 滴定管中。
②本实验___________ (填“需要”或“不需要”)指示剂。
③下列操作会使测定结果偏高的是_____
A.锥形瓶洗净后还留有蒸馏水
B.部分KMnO4溶液滴到锥形瓶外
C.盛装KMnO4溶液的滴定管滴定前读数正确,滴定后仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去括号内杂质的有关试剂正确的是
A.苯(硝基苯):蒸馏水B.苯(Br2):NaOH溶液
C.乙酸(乙酸乙酯):氢氧化钠溶液D.乙烷(乙烯):酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学的核心就是利用化学原理从源头上减少或消除工业生产对环境的污染。下列属于绿色化学的是
A. 氢能源代替化石能源 B. 污水的治理
C. 废弃塑料的回收和利用 D. 焚烧“白色污染”物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com