
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化关系的是
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | S | SO3 | H2SO4 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】铟(49In)与铷(37Rb)同周期。下列说法错误的是
A. In原子核外有5个电子层B. ![]() In的中子数与电子数的差值为17
In的中子数与电子数的差值为17
C. 碱性:In(OH)3<RbOHD. 原子半径:In>Rb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某二次电池充电时的工作原理示意图,该过程可实现盐溶液的淡化。下列说法错误的是
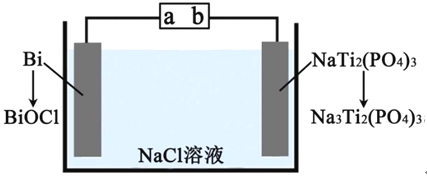
A. 充电时,a为电源正极
B. 充电时,Cl-向Bi电极移动,Na+向NaTi2(PO4)2电极移动
C. 充电时,新增入电极中的物质:n(Na+):n(Cl-)=1:3
D. 放电时,正极的电极反应为BiOCl+2H++3e-=Bi+Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是由4个碳原子结合成的4种烃(氢原子没有画出)。
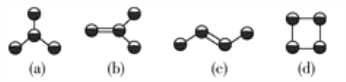
(1)写出有机物(b)的系统命名法的名称:________。
(2)上述有机物中,分子中碳原子一定在同一平面的是______________、______________(填结构简式)。
(3)上述有机物中不能与溴水发生反应使其褪色的有______(填字母代号)。
(4)等质量的上述四种物质完全燃烧耗氧量最大的是______(填结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的工作原理:
ⅰ.充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
ⅱ.放电过程原理示意图如图所示:
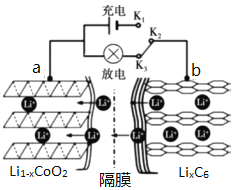
①放电时,电流从______(填“a”或“b”)极流出。
②充电时,a极的电极反应式为______。
(2)钴酸锂回收再生流程如下:
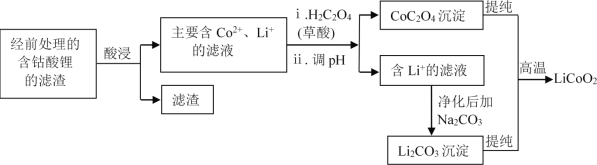
①用H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是______。
②用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸,主要原因之一是:会产生有毒、有污染的气体。写出相应反应的化学方程式_______。
③其他条件不变时,相同反应时间,随着温度升高,含钴酸锂的固体滤渣在H2SO4和30% H2O2 混合液中的浸出率曲线如图,请解释温度高于80℃,钴的浸出率变化的原因:______。
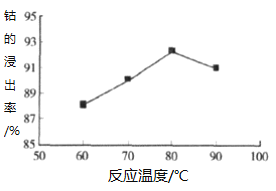
④高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以孔雀石[主要成分是CuCO3·Cu(OH)2,还含有少量杂质FeO、Fe2O3、SiO2]为原料制备CuSO4·5H2O步骤如下:
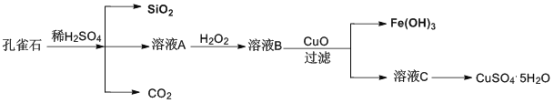
请回答下列问题:
(1)溶液A的金属离子有Fe3+和___。检验溶液A中含有Fe3的试剂是___。
(2)溶液A中加入H2O2的目的是___,发生的离子方程式为___。
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、___、过滤等操作。
(4)溶液B与CuO反应生成Fe(OH)3和溶液C的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。在一定条件下的以下反应中,最符合绿色化学概念的是( )
A. 用水吸收二氧化氮得到硝酸B. 铝盐溶液与氨水反应制氢氧化铝
C. 苯与液溴反应制溴苯D. 乙烯与氯化氢反应制备氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:

(1)将标准状况下___L氯化氢气体通入1.00L水中可得36.5%的浓盐酸,该浓盐酸中HCl的物质的量浓度为___mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是_____。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取___mL上述浓盐酸进行配制。
②配制仪器除烧杯、量筒和玻璃棒,还需要的仪器是___、____。
③配制时,下列操作正确的顺序是(用字母表示)____。
A.洗涤 B.定容 C.溶解 D.摇匀 E.冷却 F.称量 G.转移
④在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”或“无影响”)。
Ⅰ.未等稀释后的溶液冷却到室温就转移到容量瓶(______)
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。(______)
Ⅲ.配制时,容量瓶有少量蒸馏水(______)
Ⅳ.定容时仰视刻度线。(_______)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2·12H2O俗称铵明矾,其性质稳定,是化学实验常用的基准试剂。用碳酸氢铵与硫酸钠可以制备纯净的铵明矾,制备过程如图,下面说法不正确的是
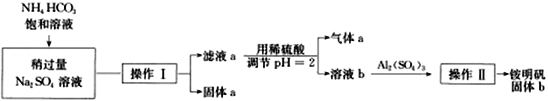
A.加入NH4HCO3饱和溶液发生反应的离子方程式:Na++HCO3-=NaHCO3↓
B.调节pH时,为了减少损耗,提高产率,可将pH试纸直接浸入滤液a中
C.操作Ⅱ的基本过程为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.若过量的气体a通入到饱和的纯碱溶液中会有晶体析出,该晶体与固体a相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com