
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是

A.a和b都属于芳香烃
B.a和c分子中所有碳原子均处于同一平面上
C.在一定条件a、b和c均能与氢气发生加成反应
D.b和c均能与新制Cu(OH)2悬浊液反应生成砖红色沉淀
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
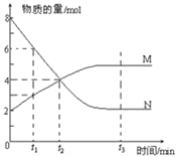
(1)该反应的化学方程式是_____________________________
(2)在图上所示的三个时刻中___________(填t1、t2或t3)时刻处于平衡状态,此时v正________v逆(填>、<或=);达到平衡状态后,平均反应速率v(N):v(M)=___________
(3)若反应容器的容积不变,则“压强不再改变”_________(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是________(选填字母) A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
(5)向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O22SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为________;平衡时SO3的物质的量浓度________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述正确的是( )
A.pH值等于5的HCl溶液和PH值等于9的NaOH溶液由水电离出的c(H+)之比为1:1
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.PH=2的HNO3溶液和PH=10的Ba(OH)2溶液等体积混合后的溶液的PH=7
D.向0.1 mol/L的氨水中加入少量醋酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AG=lg![]() ,电离度α=
,电离度α=![]() ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
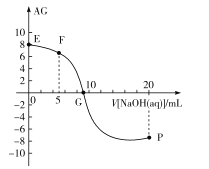
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=______________。
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①用H2表示前2 h 的平均反应速率v(H2)=_________________________________;
②该温度下,CO2的平衡转化率为________。
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①该反应的ΔH________0(填“>”或“<”)。
②曲线c表示的物质为_______。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施______________。(答出一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示物质A~F之间的转化关系,其中A为淡黄色固体物质,B、C为无色溶液,D为气体,E、F为白色沉淀。请填写下列各空:
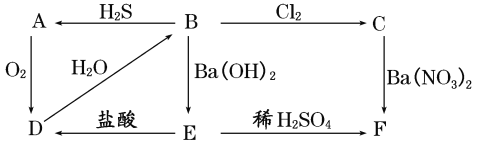
(1)写出各物质的化学式:
A为______,B为_____,C为_____,D为_____,E为_____,F为______。
(2)写出下列反应的化学方程式:
B→A:________________________。
B→C:___________________________。
(3)写出C→F的离子方程式:___________________。
(4)在A~F六种物质中,既有氧化性又有还原性的是(填字母代号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧后的主要产物。
(1)将体积比为2:1的CO2和CO混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃。将残留固体溶于水,所得溶液中2c(CO32-)+c(HCO3-)____________c(Na+)(填“>”“<”或“=”) 。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ/mol;键能E(o=o)=499.0 kJ/mol
①CO(g)+O2(g)![]() CO2(g)+O(g) 的△H=____________kJ/mol
CO2(g)+O(g) 的△H=____________kJ/mol
②已知2500K时,①中反应的平衡常数为0.40。某时刻该反应体系中各物质浓度满足: c(CO)·c(O2)=c(CO2)·c(O),则此时反应____________(填向左”或“向右”)进行。
(3)已知:反应CO2(g)![]() CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)
CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)![]() 2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2,
2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2, 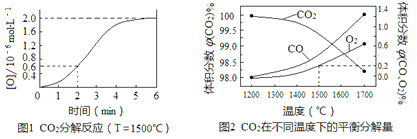
①分析图1,求2min内v(CO2)=_______。
②分析图2,1500℃时反应达平衡,此时容器体积为1 L,则反应的平衡常数K=______(计算结果保留1位小数)。
(4)为探究不同催化剂对CO和H2合成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1:3进行实验,得到如下数据:
选项 | T/K | 时间/min | 催化剂种类 | 甲醇的含量(%) |
A | 450 | 10 | CuO-ZnO | 78 |
B | 450 | 10 | CuO-ZnO-ZrO2 | 88 |
C | 450 | 10 | ZnO-ZrO2 | 46 |
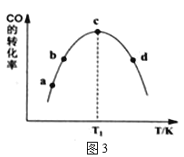
①由表1可知,该反应的最佳催化剂为____________(填编号);图3中a、b、c、d四点是该温度下CO的平衡转化率的是____________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有____________。
A. 使用催化剂CuO-ZnO-ZrO2 B. 适当降低反应温度
C. 增大CO和H2的初始投料比 D. 恒容下,再充入a mol CO和3a mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25°C时,若向a mol·L-1的HA溶液中,滴加等体积的b mol·L-1的NaOH溶液,使溶液呈中性,用含a的代数式表示HA的电离平衡常数Ka=____________。
(2)25°C时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应完后溶液中c(NH4+)=c(Cl-),则溶液显_____性(填“酸”、“碱”或“中”),用含a的代数式表示NH3·H2O的电离平衡常数Kb=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源,石墨为电极电解CuSO4溶液(足量),装置如下图。若一段时间后Y电极上有6.4 g红色物质析出,停止电解。下列说法正确的是( )
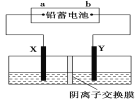
A.a为铅蓄电池的负极
B.电解过程中SO42-向右侧移动
C.电解结束时,左侧溶液质量增重8 g
D.铅蓄电池工作时正极电极反应式为:PbSO4+2e-===Pb+SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com