
A、N2的电子式: |
| B、CO2的电子式:O::C::O: |
C、NaCl的电子式: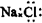 |
D、F-的结构示意图: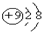 |
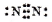 ,故A错误;
,故A错误;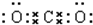 ,故B错误;
,故B错误;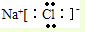 ,故C错误;
,故C错误; ,故D正确;
,故D正确;

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| 实验序号 | (1) | (2) | (3) |
| 取用盐酸的体积/mL | 25 | 25 | 25 |
| 取用混合物的质量/g | 1.32 | 1.54 | 2.20 |
| 生成气体的体积(标准状况)/mL | 336 | 392 | 448 |
| A、1.2 | B、1.4 |
| C、1.6 | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L |
| B、2.8 mol/L |
| C、0.2 mol/L |
| D、0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、木炭与氧化铜在高温下反应生成铜和二氧化碳 |
| B、12份质量的碳可与160份质量的氧化铜在高温下反应生成128份质量的铜和44份质量的二氧化碳 |
| C、若以NA代表6.02×1023个粒子,则NA个碳原子与2NA个氧化铜分子在高温下反应,生成2NA个铜原子和NA个二氧化碳分子 |
| D、一个碳原子和两个氧化铜分子高温加热时可生成两个铜原子和一个二氧化碳分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,46g NO2含有2NA个氧原子 |
| B、常温常压下,22.4LCCl4含有个NA个CCl4分子 |
| C、标准状况下,22.4L空气含有NA个单质分子 |
| D、由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中由水电离的c(H+)=1×10-10mol/L |
| B、pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-)>c(H+) |
| C、浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
| D、0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合后所得溶液中c(H+)+c(HA)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com