
【题目】下图为周期表中短周期的一部分,W、X、Y、Z四种元素最外层电子数之和为24。下列说法正确的是
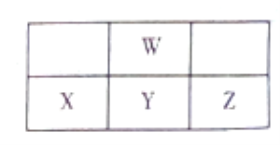
A. X、Y、Z的含氧酸的酸性依次增强
B. W元素形成的单核阴离子还原性强于X
C. Y、W形成的化合物一定能使酸性KMnO4溶液褪色
D. W与氢元素形成的化合物中可能含有非极性键
【答案】D
【解析】
设Y的最外层电子数为n,则W、X、Z的原子序数分别为n、n-1、n+1,则有n+n+n-1+n+1=24,n=6,则W为O元素,X为P元素,Y为S元素,Z为Cl元素,结合原子结构和性质解答。
A.X、Y、Z在同一周期,自左向右,非金属性逐渐增强,非金属性越强,对应的最高价含氧酸酸性越强,但选项中不一定为最高价,故A错误;
B.非金属性W(O)>X(P),元素的非金属性越强,对应的阴离子的还原性越弱,故B错误;
C. O、S形成的化合物有SO2和SO3,SO2具有还原性能使酸性KMnO4溶液褪色,SO3没有还原性不能使酸性KMnO4溶液褪色,故C错误;
D.O与氢元素形成的化合物可能为H2O2,含有非极性键,所以D选项是正确的。
所以D选项是正确的。


科目:高中化学 来源: 题型:
【题目】关于键长、键能和键角的说法中不正确的是( )
A. 键角是描述分子立体结构的重要参数
B. 键长的大小与成键原子的半径和成键数目有关
C. 键能越大,键长就越长,共价化合物也就越稳定
D. 键角的大小与键长、键能的大小无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pK=-lgK,25℃时,二元酸H2A的pK1=1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2-)=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中存在大量元素,在工农业生产中有广泛应用。回答下列问题:
(1)人工合成的蓝宝石晶体(Al2O3)是目前半导体工业中应用最广泛的材料。
①基态Al原子中有______种运动状态不同的电子,核外电子占据最高能级的符号是_____,占据该能级电子的电子云轮廓图形状为_______。
②比较第一电高能:Mg______Al(填“>”、”<”或“=”)。在现代化学中,常利用_________上的特征谱线来鉴定元素,称为光谱分析。
(2)羰基硫(COS)存在于许多种植物中,杀虫效果显著。
①1molCOS分子中含有σ键的数目为_____,其中心原子的杂化方式为_____。
②CS2、CO2、COS的分解温度由低到高的顺序为_____。
(3)NaCl 和MgO都属于离子化合物.NaC1的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_______________。
(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
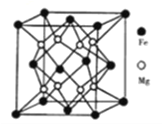
则:①距离一个Fe原子最近的Mg原子个数是______,与此晶胞结构相似的常见的离子晶体是______(填名称)。
②若该晶体储氢时,H2 分子在晶胞的体心和棱心位置,晶胞的参数为dnm,則距离最近的两个H2分子之间的距离为______cm;含铁56g的该储氢合金可储存标准状况下H2 的体积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是:
混合物 | 试剂 | 分离方法 | |
A | 苯(甲苯) | 溴水 | 分液 |
B | 乙烷(乙烯) | 氢气 | 加热 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种溶液:①醋酸溶液,②盐酸.下列说法错误的是( )
A.两溶液中水电离出的c(H+):①=②
B.两溶液分别加水稀释10倍,稀释后溶液的pH:②>①
C.取大小和形状完全相同的两块锌粒分别投入两种酸中,当产生相同体积的气体时所需的时间:①>②
D.等体积的两溶液分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均是原子序数小于36的元素.A的基态原子外围电子排布式为3s2;B原子的L电子层的P能级上有一个空轨道; C元素的基态原子最外层有3个未成对电子,次外层有2个电子; D 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2. 根据信息回答下列问题:
(1)C的外围电子排布图为 . C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为
(2)用电子式表示化合物AE2的形成过程
(3)F与BD易形成配合物F(BD)5 , 在F(BD)5中F的化合价为
(4)E有多种含氧酸根①EO﹣②EO2﹣③EO3﹣④EO4﹣ , 其中空间构型为四面体形的是(填序号).
(5)C 的最高价氧化物对应的水化物与A 的单质反应时,C被还原到最低价,该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期主族元素W、M、X、X、Z原子序数依次增大,请结合表中信息回答下列问题:
元素 | W | M | X | Y | Z |
结构或性质 | 最高价含氧酸与其气态氢化物能发生化合反应 | 氢化物的水溶液能刻蚀玻璃 | 焰色反应呈火焰黄色 | 同周期主族元素形成的简单离子中,其离子半径最小 | 最高正价与最低负价代数和为6 |
(1)M元素在周期表中的位置为____________。
(2)M、X、Z元素所对应简单离子半径由大到小的顺序为__________(用离子符号表示)。
(3)W最高价含氧酸与其气态氢化物发生化合反应生成的物质中含有的化学键类型为_____。
(4)下列可作为比较M和Z的非金属性强弱的依据是_______(填序号)。
A.单质与H2反应的难易程度 B.氢化物的稳定性
C.最高价氧化物的水化物酸性强弱 D.将M的单质通入Z的钠盐溶液观察是否有Z逸出
(5)常温下,4.6gX单质在空中燃烧,再恢复到常温,放出QkJ能量,该反应的热化学方程式为_______________。
(6)W能形成多种氢化物,其中-种氢化物可作为火箭燃料,该物质中W与氢元素的质量比为7:1,写出该氢化物的电子式___________。该氢化物和O2在碱性条件下可形成燃料电池,产生两种无毒物质,写出其负极的电极反应式____________。
(7)Y元素和W元素形成的化合物YW一种新型无机材料,可与过量烧碱溶液反应产生使湿润的红色石蕊试纸变蓝的气体,写出有关的化学方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com