
【题目】As2O3在玻璃工业中常用作澄清剂和脱色剂,工业上采用酸性高浓度含砷废水(主要以H3AsO3形式存在)提取As2O3的工艺流程如下:
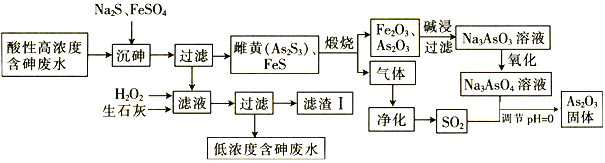
回答下列问题:
(1)上述流程的_____过程中由于条件的原因,造成生成物中混有Fe3O4,为证明Fe3O4的存在,可利用Fe3O4具有_______性的这一物理性质。
(2)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为________。
(3)常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示:

①H3AsO3为_______元_______(填“强”或“弱”)酸。
②pH由7调节至10的过程中发生反应的离子方程式为__________。
③H3AsO3的一级电离平衡常数Ka1=__________。
(4)滤渣Ⅰ中含有FeAsO4、Fe(OH)3、Ca3(AsO4)2和 _______(填化学式);已知Ksp[FeAsO4]=5.7×10-21 ,含砷污染物允许排放标准为不大于0.5 mgL-1。若低浓度含砷废水(假设砷均以Na3AsO4形式存在)中Fe3+的浓度为1. 0×10-4 molL-1 ,则低浓度含砷废水中Na3AsO4的浓度为_____ mgL-1,_____(填“符合”或“不符合”)排放标准。
【答案】煅烧 磁 2AsO43-+2SO2+2H+=As2O3↓+SO42-+H2O 三 弱 H3AsO3+OH-=H2AsO3-+H2O 10-9 CaSO4 1.1856×10-11 符合
【解析】
酸性高浓度含砷废水加入硫化钠、硫酸亚铁,其中硫酸亚铁可除去过量的硫离子,过滤得到As2S3和FeS,滤液含有亚铁离子以及少量的砷等,加入过氧化氢氧化冶铁离子,加入氢氧化钙可生成FeAsO4、Fe(OH)3、Ca3(AsO4)2,以及硫酸钙等,As2S3和FeS焙烧,可生成As2O3、氧化铁,加入氢氧化钠溶液生成Na3AsO3,氧化生成Na3AsO4,生成的气体为二氧化硫,与Na3AsO4在酸性条件下发生氧化还原反应生成As2O3,据此分析解答。
(1)FeS在煅烧时,可生成有Fe3O4,Fe3O4俗名磁性氧化铁,具有磁性,利用Fe3O4具有磁性检验是否存在Fe3O4,故答案为:煅烧;磁;
(2)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O,故答案为:2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O;
(3)①由图象可知,H3AsO3与NaOH溶液反应生成AsO33-,可说明H3AsO3为三元酸,在根据溶液中还存在和H2AsO3-、HAsO32-,说明H3AsO3为弱酸,故答案为:三;弱;
②根据图象可知,pH由7调至10时,H3AsO3转化为H2AsO3-,反应的离子方程式为:H3AsO3+OH-=H2AsO3-+H2O,故答案为:H3AsO3+OH-=H2AsO3-+H2O;
③根据图象,pH=9时,c(H3AsO3)=c(H2AsO3-),H3AsO3的一级电离方程式为H3AsO3H2AsO3-+H+,平衡常数Ka1= =c(H+)=10-9,故答案为:10-9;
=c(H+)=10-9,故答案为:10-9;
(4)加入石灰水,滤渣I中除含有FeAsO4、Fe(OH)3、Ca3(AsO4)2,还含有CaSO4,Fe3+的浓度为1.0×10-4molL-1,则c(AsO43-)=![]() mol/L=5.7×10-17mol/L,则1L废水中含有As的物质的量为5.7×10-17mol,质量为1.1856×10-11mg,小于0.5mgL-1,符合排放标准,故答案为:CaSO4;1.1856×10-11;符合。
mol/L=5.7×10-17mol/L,则1L废水中含有As的物质的量为5.7×10-17mol,质量为1.1856×10-11mg,小于0.5mgL-1,符合排放标准,故答案为:CaSO4;1.1856×10-11;符合。


科目:高中化学 来源: 题型:
【题目】已知:CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH = -Q1
2H2(g) + O2(g) = 2H2O(g) ΔH = -Q2; 2H2(g) + O2(g) = 2H2O(l) ΔH = -Q3
常温下,取甲烷和氢气体积比为4:1的混合气体11.2L(已折合成标准状况),完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1 + 0.05Q2B.0.4Q1 + 0.05Q3C.0.4Q1 + 0.1Q2D.0.4Q1 + 0.1Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_____△H2(填“>”“<”或“=”,下同)。
(2)相同条件下,1 mol P4所具有的能量_______4 mol P原子所具有的能量。
(3)己知P4(白磷,s)![]() 4P(红磷,s) △H=-17 kJ· mol-1,比较下列反应中△H的大小:△H1_____△H2。
4P(红磷,s) △H=-17 kJ· mol-1,比较下列反应中△H的大小:△H1_____△H2。
①P4(白磷,s)+5O2(g)=P4O10(s) △H1,
②4P(红磷,s)+5O2(g)=P4O10(s) △H2。
(4)己知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ· mol-1,则浓硫酸与稀氢氧化钠溶液反应生成2 mol水,放出的热量______114.6kJ。
(5)己知:28gFe(s)与CO2(g)在一定条件下,完全反应生成FeO(s)和CO(g),吸收了a kJ热量,该反应的热化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是___,基态D原子价电子的轨道表达式为___,DA2分子的VSEPR模型是___。
(2)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图1所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
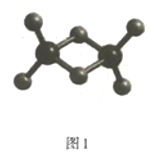
①C2Cl6属于___晶体(填晶体类型),其中C原子的杂化轨道类型为___杂化。
②[C(OH)4]-中存在的化学键有___。
③C2Cl6与过量的NaOH溶液反应的化学方程式为___。
(3)B、C的氟化物晶格能分别是2957kJmol-1、5492kJmol-1,二者相差很大的原因是___。
(4)D与E所形成化合物晶体的晶胞如图2所示。
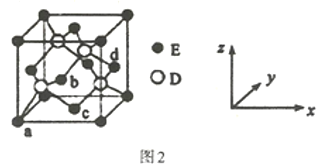
①在该晶胞中,E的配位数为___。
②已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为___pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H的分子中含有醛基和酯基。H可以用C和F在一定条件下合成(如图):
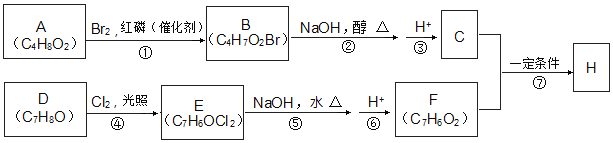
已知以下信息:
①A的核磁共振氢谱中有三组峰;且能与饱和碳酸氢钠溶液反应放出CO2。
②RCH2COOH 。
。
③化合物D苯环上的一氯代物只有两种。
④通常同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)A的名称为___。
(2)D的官能团名称为___。
(3)反应②的化学方程式为__,⑦的反应类型为___。
(4)F的结构简式为__。
(5)H在一定条件下反应生成高聚物的化学方程式为___。
(6)F的同系物G比F相对分子质量大14,G的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基;②不能使FeCl3溶液显色,共有__种(不考虑立体异构)。其中能与碳酸氢钠溶液反应且核磁共振氢谱为4组峰,且峰面积比为3:2:2:1,写出G的这种同分异构体的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d四种短周期元素在周期表中的位置如图所示,a和b分别位于周期表的第2列和第13列,下列叙述正确的( )

A.离子半径b>d
B.b可以和强碱溶液发生反应
C.c的最简单氢化物的空间结构为三角锥形
D.a的最高价氧化物对应水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产硝酸钙的工业废水常含有 NH4NO3,可用电解法净化。其工作原理如图所 示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的()
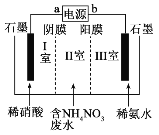
A.a 极为电源正极,b 极为电源负极
B.装置工作时电子由 b 极流出,经导线、电解槽 流入 a 极
C.I 室和 III 室最终均能得到副产品 NH4NO3
D.阴极电极反应式为 2NO3-+12H++10e-==N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)碱性燃料电池的原理示意图如图所示,电池总反应为:N2H4+O2=N2+2H2O。下列说法错误的是

A.电极b发生还原反应
B.电流由电极a流出经用电器流入电极b
C.物质Y是NaOH溶液
D.电极a的电极反应式为N2H4 + 4OH--4e-=N2↑ + 4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为 CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟 气脱硫。已知:①C(s)+O2(g)=CO2(g)ΔH1= -393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) ΔH3= -296.0kJ·mol-1
CO将SO2还原为单质硫的热化学方程式为_______。
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生 反应CO(g)+2H2(g)![]() CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
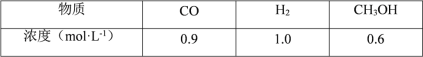
①反应达到平衡时,CO的转化率为_______。
②该反应的平衡常数值 K=_______。
③恒温恒容条件下,可以说明反应已达到平衡状态的是_______(填标号)。
A v 正(CO)=2v 逆(H2) B 混合气体的密度不变
C 混合气体的平均相对分子质量不变 D CH3OH、CO、H2 的浓度都不再发生变化
④若保持容器体积不变,再充入 0.6mol CO 和 0.4mol CH3OH,此时v正_______v逆(填“ >” 、< ”或“= ”)。
(3)在常温下,亚硝酸HNO2的电离常数 Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数 Kb=1.7×10-5mol·L-1。0.1mol·L-1 NH4NO2溶液中离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kh=_______(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com