
【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为 CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟 气脱硫。已知:①C(s)+O2(g)=CO2(g)ΔH1= -393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) ΔH3= -296.0kJ·mol-1
CO将SO2还原为单质硫的热化学方程式为_______。
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生 反应CO(g)+2H2(g)![]() CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
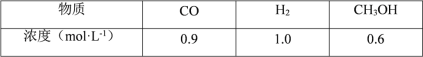
①反应达到平衡时,CO的转化率为_______。
②该反应的平衡常数值 K=_______。
③恒温恒容条件下,可以说明反应已达到平衡状态的是_______(填标号)。
A v 正(CO)=2v 逆(H2) B 混合气体的密度不变
C 混合气体的平均相对分子质量不变 D CH3OH、CO、H2 的浓度都不再发生变化
④若保持容器体积不变,再充入 0.6mol CO 和 0.4mol CH3OH,此时v正_______v逆(填“ >” 、< ”或“= ”)。
(3)在常温下,亚硝酸HNO2的电离常数 Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数 Kb=1.7×10-5mol·L-1。0.1mol·L-1 NH4NO2溶液中离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kh=_______(保留两位有效数字)。
【答案】2CO(g)+SO2(g)=2CO2(g)+S(s) ΔH=-270kJ·mol-1 40% ![]() CD = c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11
CD = c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11
【解析】
(1)根据盖斯定律分析,将几个热化学方程式即反应热进行计算即可;
(2)列出反应的三段式进行分析;
(3)由题知,HNO2的电离常数大于NH3·H2O,则NH4NO2溶液中,NH4+的水解程度大于NO2-的水解程度,则溶液中c(NO2-)>c(NH4+);Kh=![]() 。
。
(1)根据盖斯定律可得,该反应=反应①-反应②-反应③,ΔH=ΔH1-ΔH2-ΔH3,即该反应的热化学方程式为:2CO(g)+SO2(g)=2CO2(g)+S(s) ΔH=-270kJ·mol-1;
(2)该反应的三段式如下:

①α(CO)=![]() =40%;
=40%;
②K=![]() =
=![]() =
=![]() ;
;
③A、平衡时,2v正(CO)=v逆(H2); v正(CO)=2v逆(H2)是某一个点时,体系中的速率关系,且一定不是平衡时的速率关系,故该说法不能说明反应达到平衡,A错误;
B、根据质量守恒定律,反应体系的总质量始终不变,由于该反应是在恒容的容器中进行的,故反应体系的密度始终不变,故该说法不能说明反应达到平衡,B错误;
C、根据质量守恒定律,反应体系的总质量始终不变,但是反应体系的总物质的量在减小,即在反应体系达到平衡之前,反应体系的平均相对分子质量在增大,故当混合气体的平均相对分子质量不再变化时,反应达到平衡,C正确;
D、反应体系的各组分的浓度不再变化时,反应达到平衡,D正确;
故选CD;
④保持容器体积不变,再充入0.6mol CO和0.4mol CH3OH,c(CO)=1.5mol·L-1,c(H2)=1.0mol·L-1,c(CH3OH)=1.0mol·L-1,Qc=![]() =
=![]() =
=![]() =K,则平衡不移动,即v正=v逆;
=K,则平衡不移动,即v正=v逆;
(3)由题知,HNO2的电离常数大于NH3·H2O,则NH4NO2溶液中,NH4+的水解程度大于NO2-的水解程度,故该溶液中各离子浓度由大到小为:c(NO2-)>c(NH4+)>c(H+)>c(OH-);NO2-的水解平衡常数Kh=![]() =
=![]() =
=![]() =
=![]() =1.4×10-11。
=1.4×10-11。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】As2O3在玻璃工业中常用作澄清剂和脱色剂,工业上采用酸性高浓度含砷废水(主要以H3AsO3形式存在)提取As2O3的工艺流程如下:
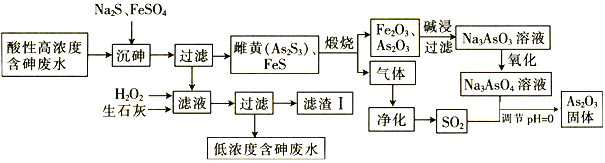
回答下列问题:
(1)上述流程的_____过程中由于条件的原因,造成生成物中混有Fe3O4,为证明Fe3O4的存在,可利用Fe3O4具有_______性的这一物理性质。
(2)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为________。
(3)常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示:

①H3AsO3为_______元_______(填“强”或“弱”)酸。
②pH由7调节至10的过程中发生反应的离子方程式为__________。
③H3AsO3的一级电离平衡常数Ka1=__________。
(4)滤渣Ⅰ中含有FeAsO4、Fe(OH)3、Ca3(AsO4)2和 _______(填化学式);已知Ksp[FeAsO4]=5.7×10-21 ,含砷污染物允许排放标准为不大于0.5 mgL-1。若低浓度含砷废水(假设砷均以Na3AsO4形式存在)中Fe3+的浓度为1. 0×10-4 molL-1 ,则低浓度含砷废水中Na3AsO4的浓度为_____ mgL-1,_____(填“符合”或“不符合”)排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原儿茶醛是一种医药中间体,一种合成路线如图: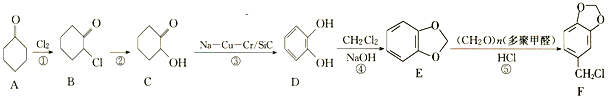
回答下列问题:
(1)A中的官能团名称是________。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。B中____(填“有”或“没有”)手性碳。
(3)反应①的类型是__________;反应②所需试剂和条件分别为________。
(4)原儿茶醛的分子式为________。
(5)W与C互为同分异构体,W中不含环状结构,能发生水解反应,核磁共振氢谱只有3组峰且峰面积之比为6∶3∶1,W的结构简式为_________(只写一种)。
(6)设计以苯酚和(CH2O)n为原料制备 的合成路线_______。(无机试剂任选)。已知:苯酚在多聚甲醛和氯化氢作用下,在邻位发生取代反应。
的合成路线_______。(无机试剂任选)。已知:苯酚在多聚甲醛和氯化氢作用下,在邻位发生取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:

关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
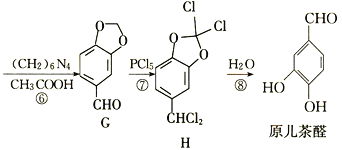
【题目】高聚物H是一种光刻胶,其中的一种合成路线如下:

回答下列问题:
(1)B的化学名称是_________。
(2)B生成C的反应类型为_________,F与G反应生成H的反应类型为_________。
(3)H中官能团的名称为___________________________。
(4)C的结构简式为__________________,G的结构简式为__________________。
(5)已知E与D,F与CH3OH分别含有相同的官能团,写出D与CH3OH反应生成E和F的化学方程式:________。
(6)芳香族化合物X是G的同分异构体,1 mol X与足量银氨溶液反应生成4 mol Ag,则X的结构简式有_____(不考虑立体异构)种,写出核磁共振氢谱显示有五种不同化学环境的氢,且峰面积之比为1:2:2:2:1的X的结构简式:___________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工小组研究银铜复合废料(表面变黑,生成Ag2S)回收银单质及制备硫酸铜晶体,工艺如下 :(废料中的其他金属含量较低,对实验影响可忽略)

已知:① AgCl可溶于氨水,生成[Ag(NH3)2]+;
② Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10;
③渣料中含有少量银和硫酸银(微溶)。
(1)操作I中为了加快空气熔炼速率,可以采取____________措施(写出其中一种即可)。
(2)操作IV经过_______________、_________________、过滤、洗涤和干燥,可以得到硫酸铜晶体。
(3)洗涤滤渣II,与粗银合并,目的是________________________________。
(4)操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为_________________________________(其中AgCl和NaCl的物质的量之比为2:1)。氧化的同时发生沉淀转化,离子方程式为______________________________,其平衡常数K=_____________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
|
|
|
|
NaCl溶于水 | 铁的吸氧腐蚀原理 | 铜锌原电池构造和原理 | N2与O2反应能量变化 |
NaCl=Na+ + Cl- | 负极:Fe - 2e-=Fe2+ | 总反应:Zn + Cu2+=Zn2+ + Cu | N2(g) + O2(g)=2NO(g)ΔH=-180 kJ·mol-1 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的反应:2SO2(g) + O2(g) ![]() 2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
A. 正、逆反应速率都等于零 B. SO2、O2、SO3的浓度相等
C. SO2、O2、SO3在容器中共存 D. SO2、O2、SO3的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银由于其优良的性能和特性被广泛应用于照相、电子、电气等工业。废定影液中银主要以Na3Ag(S2O3)2形式存在,实验室用废定影液制备Ag的具体流程如图所示:
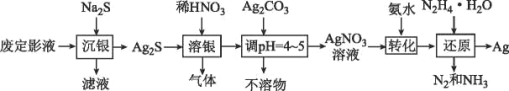
注:“还原”时由于Ag+直接与N2H4H2O反应过于激烈,所以采用加入氨水,使Ag+与氨形成[Ag(NH3)2]+,降低Ag+的浓度,从而相应降低Ag+的氧化能力,使反应能够平稳进行。
回答下列问题:
(1)“溶银”时产生的气体是___(填化学式)。
(2)N2H4H2O(水合肼)为无色透明的油状发烟液体,具有强还原性,实验室制备原理为NaClO+2NH3=N2H4H2O+NaCl,可能用到的实验装置如图所示:
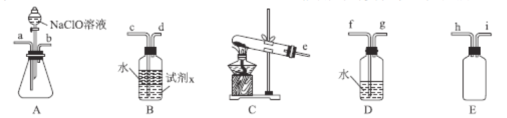
①本实验中用不到的装置是___。(填字母),试剂x是___(填化学式,任写一种)。
②加入NaClO溶液时要慢慢滴加,目的是___。
③按气流从左到右的方向,整套装置的连接顺序为___(填仪器接口小写字母)。
(3)AgNO3见光或受热易分解。将上述流程中AgNO3溶液蒸发浓缩可获得AgNO3固体,实验装置如图所示:
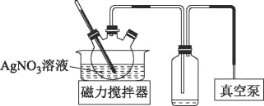
①使用真空泵的目的是___。
②测定AgNO3固体的纯度(杂质不参与反应)称取2.00g制备的AgNO3固体,加水溶解,定容到100mL;准确量取25.00mL溶液,酸化后滴入几滴NH4Fe(SO4)2溶液作指示剂,再用0.1000molL-1NH4SCN标准溶液滴定,消耗NH4SCN标准溶液的平均体积为29.00mL,则固体中AgNO3的质量分数为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com