
【题目】“垃圾是放错了位置的资源”,应该分类回收。某化学兴趣小组拟采用如下处理方法回收废电池中的资源。
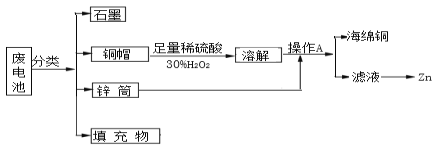
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2 , 其正极的电极反应式为_____________________________________________。
(2)操作A的名称为____________________ 。
(3)铜帽溶解时加入H2O2的目的是___________________ (用化学方程式表示)。铜帽溶解完全后,可采用________ 方法除去溶液中过量的H2O2 。
(4)填充物中可以回收得到氯化铵,写出氯化铵溶液中各离子浓度的大小顺序_________________________________。
(5)铜器在潮湿环境中发生的电化学腐蚀如图所示:
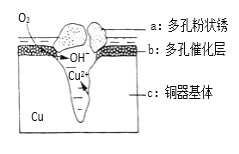
①负极反应的电极反应式 ________________________。
②环境中的Cl﹣扩散到孔口,并与正极反应产物和负极产物作用生成多孔粉状锈Cu2(OH)3Cl,其若生成4.29g Cu2(OH)3Cl,则理论上耗氧气体积为________L(标准状况)。
【答案】MnO2+eˉ+H2O═MnOOH+OHˉ 过滤 Cu+H2O2+H2SO4=CuSO4+2H2O 加热 c(Cl-)>c(NH4+)>c(H+)>c(OH-) Cu-2eˉ═Cu2+ 0.448
【解析】
(1)碱性锌锰干电池的电解质为KOH,由总反应可知,锌为负极,二氧化锰为正极,其正极的电极反应式为:MnO2+eˉ+H2O═MnOOH+OHˉ;故答案为:MnO2+eˉ+H2O═MnOOH+OHˉ;
(2)操作A是固液分离,所以为过滤操作,故答案为:过滤;
(3)铜与稀硫酸不反应,H2O2有强氧化性,酸性环境下,H2O2氧化铜生成硫酸铜,其化学反应方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,双氧水易分解生成水和氧气,所以除去溶液中过量的H2O2可用加热的方法;故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热;
(4)氯化铵为强酸弱碱盐,呈酸性,铵根离子会水解,所以溶液中各离子浓度的大小顺序为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(5)①根据图知,铜失去电子生成铜离子,氧气得电子生成氢氧根离子,发生吸氧腐蚀,则铜作负极,氧气作正极,其负极反应的电极反应式为:Cu-2eˉ═Cu2+;故答案为:Cu-2eˉ═Cu2+;
②Cl扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH+Cl= Cu2(OH)3Cl↓,则:n[Cu2(OH)3Cl]=![]() 0.02mol,根据转移电子得:n(O2)=
0.02mol,根据转移电子得:n(O2)=![]() =0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L;故答案为:0.448。
=0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L;故答案为:0.448。


科目:高中化学 来源: 题型:
【题目】今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为___堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
第一电离能 | 电负性 | 晶格能 | 沸点 |
Mg___Al | O___S | MgO___MgS | H2O___H2S |
(3)基态铬原子外围电子轨道表示式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“臭苏打”是硫化钠的俗名,又称臭碱,黄碱,硫化碱,具有臭味,硫化钠溶解于冷水,极易溶于热水,微溶于醇,是重要的化工产品。
(1)硫化钠水溶液具有臭味是S2-水解产生H2S造成的,用离子方程式解释_____________。
(2)Na2S具有较强的还原性,其水溶液在空气中会缓慢地氧化成硫代硫酸钠,写出化学方程式__________________________________。
(3)某学习小组设计实验探究金属硫化物的性质。
Ⅰ.探究Na2S的还原性
甲同学取少量硫化钠溶液于试管,滴加2滴酚酞溶液,再滴加溴水溶液,观察到溶液颜色变浅。
①酚酞的作用是____________;写出该实验的离子方程式____________________
②乙同学认为甲方案不严密。他设计方案:取少量硫化钠溶液于试管,滴加适量苯,再用长滴管加入溴水。加入“苯”的目的是_________________________
Ⅱ.探究氧化还原反应和沉淀反应的竞争
丙同学设计以下两组实验:
实验1、①在10 mL 2 mol·L-1FeCl3溶液中滴加2 mL 1 mol·L-1Na2S溶液,观察到有浅黄色沉淀生成,溶液黄色变浅。
②在10mL 2 mol·L-1Na2S溶液中滴加2mL1 mol·L-1FeCl3溶液。观察到先产生浅黄色固体,随后生成黑色固体,溶液黄色变无色。
实验2、在2 mol·L-1Na2S溶液中滴加少量AgNO3溶液,立即产生大量黑色沉淀,没有浅黄色沉淀。
实验1 中产生的浅黄色固体是_______(填化学式)。写出实验1 ②中产生黑色沉淀的离子方程式_____________;已知:氧化性有Ag+>Fe3+,实验2中,发生复分解反应,未发生氧化还原反应。
实验结论:若某一溶液中同时存在氧化还原反应和沉淀反应,则_________(填“氧化还原”或“生成更难溶物质”)反应将优先进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是( )
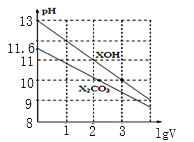
A.XOH是弱碱
B.pH=10的溶液中c(X+):XOH大于X2CO3
C.CO32-的水解常数Kh1约为1.0×10-3.8
D.当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过下列实验现象的分析,对实验事实的解释正确的是( )
A.向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2有酸性
B.H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强
C.用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色,说明浓氨水呈碱性
D.常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸发应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某简单离子的结构示意图可表示为: 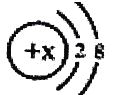 ,当x=8时,该粒子符号为________;当x=11时,该粒子符号为________;当x=13时,写出该粒子的硝酸盐的化学式为________.
,当x=8时,该粒子符号为________;当x=11时,该粒子符号为________;当x=13时,写出该粒子的硝酸盐的化学式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的C/Na4Fe(CN)6--钠离子电池是一种新型电池。下列有关说法正确的是
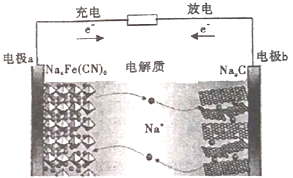
A. 电极a在放电时做正极,充电时做阴极
B. 放电时,电极b上的电极反应为:NaxC-e-=Na++Nax-1C
C. 电池工作时,Na+向电板b移动
D. 该电池通过Na+的定向移动产生电流,不发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是熔融薄膜状的碘化锂,该电池发生的总反应为2Li+P2VP·nI2![]() P2VP·(n-1)I2+2LiI。下列说法正确的是 ( )
P2VP·(n-1)I2+2LiI。下列说法正确的是 ( )
A.该电池放电时,锂电极发生还原反应
B.该电池放电时,碘离子移向正极
C.P2VP和I2的复合物是绝缘体,不能导电,充电时与外电源的负极相连
D.放电时正极的电极反应式为P2VP·nI2+2e-+2Li+=P2VP·(n-1)I2+2LiI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com