
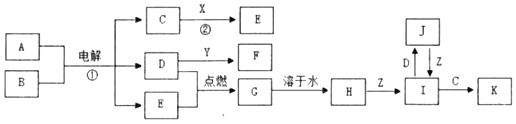
����Ŀ���й�����֮���ת����ϵ��ͼ��ijЩ��Ӧ�IJ������ʺͷ�Ӧ��������ȥ����֪X��Y��Z���ճ������г����������ʣ�X�ɵؿ��к�����ߵĽ���Ԫ����ɡ�A�Ǻ�ˮ�к��������Σ�B�dz�������ɫҺ�壬D��E�dz�����̬�ǽ������ʣ�����D�ʻ���ɫ��F��ϡ��Һ����ɫ��
��ش��������⣺
(1)�Է�Ӧ��Ϊԭ���Ĺ�ҵ����Ϊ_____��ҵ��
(2)K�Ļ�ѧʽΪ_____��
(3)��Ӧ�ڵ����ӷ���ʽΪ_____��
(4)J��Y��Ӧ�Ļ�ѧ����ʽΪ_____��
���𰸡��ȼ� Fe(OH)2 2Al+2OH��+2H2O��2AlO2��+3H2�� Cu+2FeCl3��CuCl2+2FeCl2
��������
X��Y��Z���ճ������г����������ʣ�X�ɵؿ��к�����ߵĽ���Ԫ����ɣ���XΪAl��D��E�dz�����̬�ǽ������ʣ�����D�ʻ���ɫ����DΪCl2��D��Y��Ӧ�õ�F����F��ϡ��Һ����ɫ����F����Cu2������YΪCu��FΪCuCl2��A�Ǻ�ˮ�к��������Σ���AΪNaCl��B�dz�������ɫҺ�壬�ҵ��A��B�����õ�C��D����������E����BΪH2O�����嵥��EΪH2��CΪNaOH����ת����ϵ��֪��GΪHCl��HΪ���ᡣ���������Z��Ӧ�õ�I��I�ܱ����������õ�J������ZΪ��۽���������֪ZΪFe����IΪFeCl2��JΪFeCl3��KΪFe��OH��2 ��
(1)��Ӧ��Ϊ����Ȼ�����Һ���Է�Ӧ��Ϊԭ���Ĺ�ҵ����Ϊ�ȼҵ���ʴ�Ϊ���ȼ
(2)�ɷ�����֪��K�Ļ�ѧʽΪ��Fe(OH)2���ʴ�Ϊ��Fe(OH)2��
(3)��Ӧ����Al��NaOH��Һ�ķ�Ӧ�����ӷ���ʽΪ��2Al+2OH��+2H2O��2AlO2��+3H2�����ʴ�Ϊ��2Al+2OH��+2H2O��2AlO2��+3H2����
(4)J��Y��Ӧ�Ļ�ѧ����ʽΪ��Cu+2FeCl3��CuCl2+2FeCl2���ʴ�Ϊ��Cu+2FeCl3��CuCl2+2FeCl2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��������������ó��Ľ�����ȷ���ǣ� ��
ʵ����� | ���� | ���� | |
A | ����ˮ�еμ������ữ��AgNO3��Һ | ������ɫ���� | ��ˮ�к���Cl�� |
B | ��ij��Һ�еμ����� | ����ɫ������� | ��Һ��һ����CO32�� |
C | ��ij��Һ�м����ռ���Һ����ȣ���ʪ��ĺ�ɫʯ����ֽ���� | ʯ����ֽ���� | ��Һ����NH4+ |
D | ��SO2ͨ�뵽����KMnO4��Һ�� | ��Һ�Ϻ�ɫ��ȥ | SO2����Ư���� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�����һ�ݻ�������ܱ������з������淴Ӧ2X(g) ![]() Y(g)��Z(s)�����²���˵���÷�Ӧ�ﵽ��ѧƽ��״̬����(����)
Y(g)��Z(s)�����²���˵���÷�Ӧ�ﵽ��ѧƽ��״̬����(����)
A. ���������ܶȲ��ٱ仯 B. ��Ӧ������Y��������������
C. X�ķֽ�������Y������������� D. ��λʱ��������1 mol Y��ͬʱ����2 mol X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������е绯ѧϰ�⣺
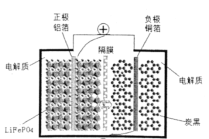
(1)ij��ع���ʱ���ܷ�Ӧ�ɼ�Ϊ��![]() ������еĹ������ʿɴ���Li+����ŵ�ʱ�������ĵ缫��ӦʽΪ________�����ʱ��Li+Ǩ�Ʒ���Ϊ____(����������������������������)��ͼ�оۺ����ĤӦΪ____(����������������)���ӽ���Ĥ��
������еĹ������ʿɴ���Li+����ŵ�ʱ�������ĵ缫��ӦʽΪ________�����ʱ��Li+Ǩ�Ʒ���Ϊ____(����������������������������)��ͼ�оۺ����ĤӦΪ____(����������������)���ӽ���Ĥ��
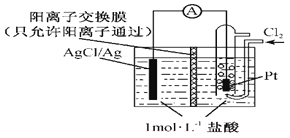
(2)ʹ�ü�ӵ�ⷨ�ɴ���ȼú�����е�NO��װ������ͼ����֪���ص�����������Һ��pH��4~7(����)֮�䣬��д�������ĵ缫��Ӧʽ______�������ӷ���ʽ��ʾ�������г�ȥNO��ԭ��________��

(3)ijԭ���װ����ͼ��ʾ������ܷ�ӦΪ2Ag+Cl2=2AgCl������ӦΪ_______���ŵ�ʱ����Ĥ�Ҳ���Һ������____(���ǿ���������������䡱)������KCl��Һ�������ᣬ�����ܷ�Ӧ______(��ı䡱���䡱)��
(4)�������������в�ȡ�˶��ַ�ֹ������ʴ�Ĵ�ʩ������ԭ���ԭ�����������ķ�����_______��
(5)��п���ᷴӦ��Ϊʲô������������ͭ�����ٷ�Ӧ_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��AlCl3��һ�ִ�����ijУѧϰС��������װ���Ʊ�����AlCl3����֪��AlCl3���������е�ˮ����ʱ�ܾ��ҷ�Ӧ����Al(OH)3��HCl��AlCl3��180��ʱ����������Ҫ�������������
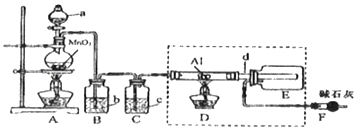
(1)����a����װ�Լ�����Ϊ_____��
(2)Bװ�õ�����Ϊ_____��
(3)�ܷ�ʡȥCװ��_____(����������������)��������_____(�û�ѧ����ʽ��ʾ)��
(4)����d���ܽϴֵ�ԭ����_____��
(5)F�м�ʯ�ҵ�����Ϊ_____(����ĸ)��
a������Cl2 b������HCl c������CO2 d������H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�صĻ��ϼ��Ʋ����ʵ������ǻ�ѧ�о�����Ҫ�ֶΡ�ͼ����Ԫ�صij������ϼ��벿���������Ķ�Ӧ��ϵ��
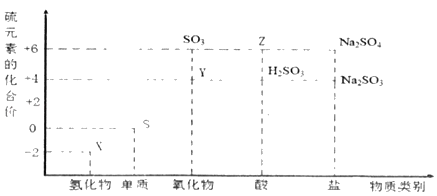
(1)����Ԫ�ػ��ϼ۱仯�ĽǶȷ�����ͼ�м������������л�ԭ�Ե�������Ϊ_____(�ѧʽ)��
(2)��X��Y��Ͽ����ɵ���ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽΪ_____��
(3)Z��Ũ��Һ��̼��һ�������¿��Է�����Ӧ��������Z��_____�ԡ�
(4)д������Ũ�����ڼ��������·�Ӧ�Ļ�ѧ����ʽ_____��
(5)Na2S2O3����Ҫ�Ļ���ԭ�ϡ���������ԭ��Ӧ�ĽǶȷ����������Ʊ�Na2S2O3�ķ��������Ͽ��е���_____(����ĸ)��
a��Na2SO3+S b��Na2S+S c��SO2+Na2SO4 d��Na2SO3+Na2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������е�һ����������巢����Ӧ��![]() ƽ��ʱ���A��Ũ��Ϊ0.50mol/L,�����¶Ȳ��䣬���������ݻ�����ԭ�����������ٴ�ƽ��ʱ,���A��Ũ��Ϊ0.30mol/L�������й��ж���ȷ����
ƽ��ʱ���A��Ũ��Ϊ0.50mol/L,�����¶Ȳ��䣬���������ݻ�����ԭ�����������ٴ�ƽ��ʱ,���A��Ũ��Ϊ0.30mol/L�������й��ж���ȷ����
A.x+y��zB.ƽ��������Ӧ�����ƶ�
C.B��ת���ʽ���D.C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�±�������Ʊ��ж��ַ���������±�������ʺ�����Ӧ������±����Ӧ�Ƶõ���
A. ![]()
B. ![]()
C. ![]()
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00 mL 0.10 mol��L1һԪ����MOH��Һ�е���0.10 mol��L1�����ᣬ��Һ��AG����������������ϵ��ͼ��ʾ����֪AG = lg ![]() ��
��
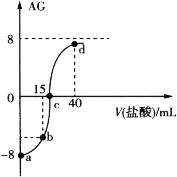
�����й���������ȷ���ǣ� ��
A.50���£�AG=0����ʱ��Һ������
B.a���Ӧ��Һ��H2O�������c��H+��=1.0��1011 mol��L1
C.b���Ӧ��Һ�� 4c��M+��+4c��MOH��=3c��Cl��
D.d���Ӧ��Һ��c��Cl��>c��H+��> c��M+��>c��MOH��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com