
(16分)某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
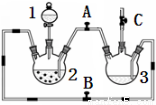
(1)稀硫酸应放在 中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关 、打开开关 就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由 
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为
滴定终点的现象是
通过实验数据计算的该产品纯度为 (用字母ac表示).上表中第一次实验中记录数据明显大于 后两次,其原因可能是
后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终 点时酸性高锰酸钾溶液的体积
点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源:2015-2016学年湖北省高二第一学期第一次月考化学试卷(解析版) 题型:选择题
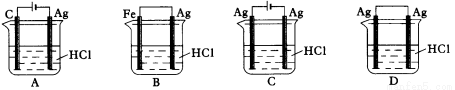
某同学为了使反应2HCl + 2Ag=2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是( )
查看答案和解析>>
科目:高中化学 来源:2016届安徽省合肥市高三上第二次段考化学试卷(解析版) 题型:选择题
卫星发射时是以N2H4(联氨)和N2O4为火箭的动力源。反应温度高达2700℃,反应式为2N2H4 + N2O4 == 3N2 + 4H2O。对于该反应的说法正确的是
A.联氨是氧化剂 B.氧化产物和还原产物的质量比为1︰2
C.属于置换反应 D.该反应的优点有热值高、无污染等
查看答案和解析>>
科目:高中化学 来源:2016届河南省洛阳市高三上学期周练化学试卷(解析版) 题型:选择题
工业上以CuFeS2为原料冶炼铜的主要反应为①2CuFeS2+4O2==Cu2S+3SO2+2FeO(炉渣);②2Cu2S+3O2=2Cu2O+2SO2;③2Cu2O+Cu2S=6Cu+SO2↑,下列说法错误的是
A.由1molCuFeS2生成1molCu,共消耗2.75molO2
B.该冶炼方法中产生大量的有害气体SO2,可回收用于制备硫酸
C.在反应③中,Cu2S既是氧化剂,又是还原剂
D.在反应①中,SO2既是氧化产物,又是还原产物
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三复习班上月考化学试卷(解析版) 题型:选择题
某氧原子的质量为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数,下列说法中正确的是
A.氧元素的相对原子质量为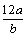
B.1mol该原子质量为aNAg
C.xg该氧原子所含的电子的个数为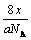
D.yg该氧原子的中子数一定为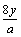
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三9月月考化学试卷(解析版) 题型:选择题
中国稀土含量丰富,稀土元素用RE表示。在稀土元素提纯过程中 可以向稀土元素的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转化为沉淀RE2(SO4)3·Na2SO4·xH2O析出,反应式RE2(SO4)3+Na2SO4+xH2O= RE2(SO4)3·Na2SO4·xH2O↓(x=1~2)。下列叙述正确的
可以向稀土元素的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转化为沉淀RE2(SO4)3·Na2SO4·xH2O析出,反应式RE2(SO4)3+Na2SO4+xH2O= RE2(SO4)3·Na2SO4·xH2O↓(x=1~2)。下列叙述正确的
A.反应生成的沉淀属于复盐 B.该反应一定在强碱溶液中进行 
C.产生沉淀的反应为复分解反应 D.产生沉淀的变化属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省五校协作体高三上学期期初考试化学试卷(解析版) 题型:填空题
(11分)七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
温度/℃ | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:
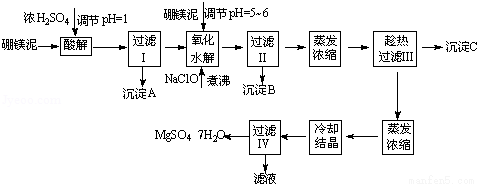
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 .
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 .
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期开学考试化学试卷(解析版) 题型:选择题
分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
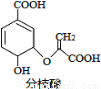
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省益阳市高一9月月考化学试卷(解析版) 题型:实验题
(8分)用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④
⑤转移、洗涤 ⑥定容、摇匀 ⑦装瓶贴标签
完成下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是 。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中_______________;
B.容量瓶用蒸馏水洗涤后残留有少量的水______________;
C.所用过的烧杯、玻璃棒未洗涤________________;
D.定容时俯视刻度线________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com