
【题目】用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).下列分析正确的是
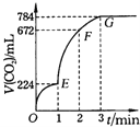
A.OE、EF、FG三段中,该反应用CO2表示的平均反应速率之比为2:6:7
B.EF段,用盐酸表示该反应的平均反应速率为2.4mol/(Lh)
C.G点表示收集的CO2的量最多
D.OE段表示的平均速率最大
【答案】C
【解析】
A.OE、EF、FG三段生成的二氧化碳体积分别为224mL、448mL、112mL,所以OE、EF、FG三段中,该反应用CO2表示的平均反应速率之比为224mL:448mL:112mL=2:4:1,选项A错误;
B.由图可知EF段生成的二氧化碳的体积为672mL-224mL=448mL,所以二氧化碳的物质的量为![]() =0.02mol,根据CaCO3+2HCl═CaCl2+CO2↑+H2O,可知参加反应的氯化氢的物质的量为0.04mol,所以盐酸的浓度变化量为
=0.02mol,根据CaCO3+2HCl═CaCl2+CO2↑+H2O,可知参加反应的氯化氢的物质的量为0.04mol,所以盐酸的浓度变化量为![]() =0.4mol/L,所以EF段用盐酸表示该反应的平均反应速率为
=0.4mol/L,所以EF段用盐酸表示该反应的平均反应速率为![]() =0.4mol/(Lmin)=24mol/(Lh),选项B错误;
=0.4mol/(Lmin)=24mol/(Lh),选项B错误;
C.G点表示收集的二氧化碳为从开始到G点生成的二氧化碳,总共784mL,选项C正确;
D.斜率表示反应速率,斜率越大反应速率越大,由图可知,EF段斜率最大,所以EF段反应速率最大,选项D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向50mL浓度均为l.0mol/L的醋酸和醋酸钠混合溶液中,缓慢滴加1.0mol/L的NaOH溶液,所得溶液的pH变化情况如图所示(已知:25℃时,Ka(CH3COOH)=1.8×10-5)。下列叙述错误的是
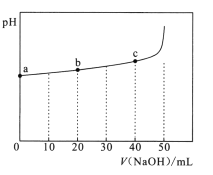
A.a点溶液中,c(H+)约为![]()
B.b点溶液中,![]()
C.V(NaOH)≤50mL时,随V(NaOH)增大,溶液中离子总浓度增大
D.从a到c的过程中,溶液中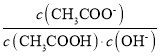 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作抗爆剂的添加剂。如图为实验室制备1,2-二溴乙烷的装罝图, 图中分液制斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。

己知:CH3CH2OH![]() CH2=CH2↑+H2O;2CH3CH2OH
CH2=CH2↑+H2O;2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)实验中应迅速将温度升卨到170℃左右的原因是______________________________。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,
请写出发生堵塞时瓶b中的现象:①_______________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是②_______________________________________________;安全瓶b还可以起到的作用是③__________________。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正确情况下超过许多,如果装罝的气密性没有问题,试分析可能的原因:______________、______________(写出两条即可)。
(5)除去产物中少量未反应的Br2后,还含有的主要杂质为___________,要进一步提纯,下列操作中必需的是_____________ (填字母)。
A.重结晶 B.过滤 C.萃取 D.蒸馏
(6)实验中也可以撤去d装罝中盛冰水的烧杯,改为将冷水直接加入到d装罝的试管中,则 此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是反应CO(g)+2H2(g)![]() CH3OH(g)进行过程中的能量变化曲线.下列相关说法正确的是
CH3OH(g)进行过程中的能量变化曲线.下列相关说法正确的是
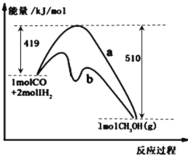
A.其它条件不变,按曲线b线进行的反应,CH3OH的产率更高
B.其它条件不变,分别按曲线a、b线进行的反应的热效应相同
C.(1molCO+2molH2)的键能之和比1molCH3OH的键能之和大
D.该反应的反应热△H= -91 kJ/mol,升高温度,正反应速率减小,逆反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在一容积可变的密闭容器中进行,试回答:
在一容积可变的密闭容器中进行,试回答:
(1)增加Fe的量,其反应速率__________(填“增大”“不变”或“减小”,下同)。
(2)将容器的体积缩小一半,其反应速率__________。
(3)保持体积不变,充入![]() 使体系压强增大,其反应速率__________。
使体系压强增大,其反应速率__________。
(4)保持压强不变,充入![]() 使容器的体积增大,其反应速率__________。
使容器的体积增大,其反应速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生发应,CO2(g)+3H2(g)CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
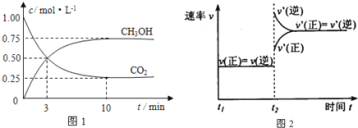
(1)从反应开始到平衡,氢气的平均反应速率υ(H2)=___。500℃达平衡时,CH3OH(g)的体积分数为___,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为___反应(填“放热”或“吸热”)。
(2)下列措施中不能使CO2的转化率增大的是___。
A.在原容器中再充入1molH2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂
E.将水蒸气从体系中分离出
(3)下列措施能使n(CH3OH)/n(CO2)增大的是___。
A.升高温度 B.恒容充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
E.恒压充入1molHe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由一种阳离子与两种酸根阴离子组成的盐称为混盐。向混盐Na4S2O3中加入足量稀硫酸,发生反应:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A. Na4S2O3的水溶液显碱性
B.1mol Na4S2O3中共含离子数为5NA
C.上述反应中,每产生3molS,转移电子的物质的量为6mol
D.CaOCl2也可称为混盐,向CaOCl2中加入足量稀硫酸会有Cl2产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com