
【题目】阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
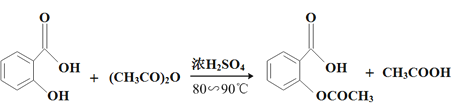
制备基本操作流程如下:

主要试剂和产品的物理常数如下表所示:
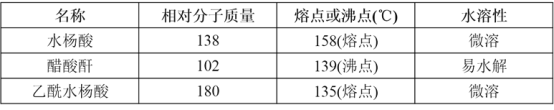
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是___。
(2)合成阿司匹林时,最合适的加热方法是___。
(3)提纯粗产品流程如下,加热回流装置如图:


①使用温度计的目的是控制加热的温度,防止___。
②冷凝水的流进方向是___(填“a”或“b”)。
③趁热过滤的原因是___。
④下列说法不正确的是___(填字母)。
A.此种提纯方法中乙酸乙酯的作用是做溶剂
B.此种提纯粗产品的方法叫重结晶
C.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
D.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为___%。
【答案】醋酸酐和水易发生反应 水浴加热 乙酰水杨酸受热易分解 a 防止乙酰水杨酸结晶析出 ABC 84.3%
【解析】
醋酸酐和水杨酸混合,然后向混合溶液中加入浓硫酸,摇匀后加热至85℃,然后冷却、过滤、水洗得到粗产品;
(1)醋酸酐和水易发生反应生成乙酸;
(2)合成阿司匹林时要控制温度在85℃~90℃,该温度低于水的沸点;
(3)向粗产品中加入乙酸乙酯,增大乙酰水杨酸的溶解性,然后加热回流,趁热过滤,然后冷却、减压过滤、洗涤、干燥得到乙酰水杨酸,
①乙酰水杨酸受热易分解;
②冷凝水采用逆流方法;
③乙酰水杨酸在温度低时易结晶析出;
不同进行分离提纯,水杨酸与乙酰水杨酸均含有羧基,且在水中微弱,不能用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸;
(4)水杨酸的相对分子质量为138,n(水杨酸)=2.0 g÷138g/mol=0.0145mol,n(乙酸酐)=(5.0 mL×1.08 g/cm3)÷102g/mol=0.0529mol,由于乙酸酐的物质的量大于水杨酸,所以得到的乙酰水杨酸应该按照水杨酸来计算,故理论上得到乙酰水杨酸的质量为0.0145mol×180g/mol=2.61g,产率=
实际质量 |
理论质量 |
×100%.
醋酸酐和水杨酸混合,然后向混合溶液中加入浓硫酸,摇匀后加热至85℃,然后冷却、过滤、水洗得到粗产品;
(1)醋酸酐和水易发生反应生成乙酸,生成的乙酸抑制水杨酸和乙酸酐反应,所以需要干燥仪器,
故答案为:醋酸酐和水易发生反应;
(2)合成阿司匹林时要控制温度在85℃90℃,该温度低于水的沸点,所以合适的加热方法是水浴加热,
故答案为:水浴加热;
(3)①乙酰水杨酸受热易分解,分解温度为128℃135℃,使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解,
故答案为:乙酰水杨酸受热易分解;
②采取逆流原理通入冷凝水,充满冷凝管,充分冷凝回流,冷凝水从a口进,从b口出,
故答案为:a;
③趁热过滤,防止乙酰水杨酸结晶析出,减少损失,
故答案为:防止乙酰水杨酸结晶析出;
④乙酸乙酯起溶剂作用,趁热过滤除去水杨酸,再冷却结晶析出乙酰水杨酸,说明低温时乙酰水杨酸在乙酸乙酯中的溶解度较小,利用水杨酸、乙酰水杨酸在乙酸乙酯中溶解度不同就行分离提纯,这种分离提纯方法为重结晶,由于水杨酸与乙酰水杨酸均含有羧基,且在水中微弱,不能用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸,
故选:ABC;
(4)水杨酸的相对分子质量为138,n(水杨酸)=2.0g÷138g/mol=0.0145mol,n(乙酸酐)=(5.0mL×1.08g/cm3)÷102g/mol=0.0529mol,由于乙酸酐的物质的量大于水杨酸,所以得到的乙酰水杨酸应该按照水杨酸来计算,故理论上得到乙酰水杨酸的质量为0.0145mol×180g/mol=2.61g,产率=实际质量理论质量×100%=2.2g2.61g×100%=84.3%,
故答案为:84.3%.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列有关含氮物质的问题:
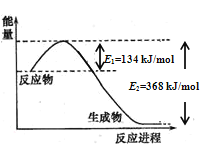
(1)图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______________________________________________;
恒温恒容条件下,不能说明该反应已达到平衡状态的是________![]() 填序号
填序号![]() 。
。
A.容器内混合气体颜色不再变化 ![]() 容器内的压强保持不变
容器内的压强保持不变
C.v逆(NO2)=v正(NO) ![]() 容器内混合气体密度保持不变
容器内混合气体密度保持不变
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)2NO(g) H>0,已知该反应在2404℃时,平衡常数K=64×10-4。
该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应的正反应速率和逆反应速率的关系:v正_____v逆(填“>”、“<”或“=”)。
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。总电池反应为N2H4+O2=N2+2H2O。该电池放电时,负极的电极反应式是______________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物燃料电池进行废水处理,可实现碳氮联合转化。某微生物燃料电池的工作原理如图所示,其中M、N为厌氧微生物电极。下列有关叙述错误的是

A.负极反应式为![]()
B.电池工作时,![]() 由M极区移向N极区
由M极区移向N极区
C.相同条件下,M极区生成的![]() 与N极区生成的
与N极区生成的![]() 的体积之比为
的体积之比为![]()
D.好氧微生物反应器中发生的反应的离子方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)可用作火箭推进剂等。制备NH4ClO4的工艺流程如下:
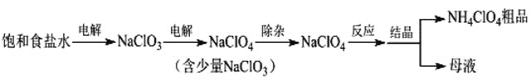
(1)电解NaClO3溶液时,ClO3-在____极发生反应,其电极反应式为____。
(2)“除杂”有两种方案。
①方案1:加入盐酸和H2O2溶液,NaClO3转化为ClO2,化学方程式为______。
方案2:加入氨水和FeCl24H2O,NaClO3转化为Cl-,离子方程式为____,如果FeCl24H2O过量会出现黑色磁性沉淀,该沉淀可能是______。(填化学式)
②比较氧化性:ClO3-_____ClO4-(填“>”或“<”)。
③两种方案相比,方案1的优点是____。(答一条即可)
(3)“反应”时用NaClO4和NH4Cl在90℃制备NH4ClO4。如果用浓盐酸和液氨代替NH4Cl,则无需加热,原因是____。
(4)该流程中可循环利用的物质是_________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某同学进行CO2与Na2O2反应的探究实验,回答下列问题。
(1)用如图装置制备纯净的CO2
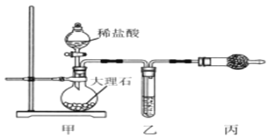
①丙装置的名称是__________,乙、丙装置中盛装的试剂分别是______、_____。
②若CO2 中混有HCl,则HCl与Na2O2反应的化学方程式为________。
(2)按照下面的装置图进行实验(夹持装置略)。
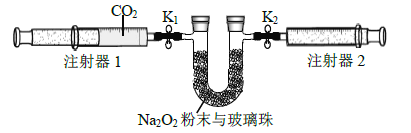
①先组装仪器,然后_____________,再用注射器1抽取100 mL 纯净的CO2,将其连接在K1 处,注射器2的活塞推到底后连接在K2 处,具支U 形管中装入足量的Na2O2 粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞,可观察到的现象是__________。
③实验过程中反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)以下物质中能导电且属于电解质的是__________,属于非电解质的是___________
①漂白粉 ②铜 ③氧气 ④BaSO4固体 ⑤稀硫酸 ⑥蔗糖 ⑦CO2⑧熔化的KNO3,
写出电离方程式:硫酸铝__________________________________________
(二)某化学实验小组需用480mL 0.2mol/L的硫酸铜溶液,请回答下列问题:
(1)如果用胆矾(CuSO45H2O)来配制,至少需用胆矾的质量为_____g。
(2)在该实验中要用到容量瓶,使用容量瓶前应_______________
(3)下面是配制硫酸铜溶液过程中的5个操作步骤:
①向盛有胆矾的烧杯中加入200ml蒸馏水使其溶解;
②继续往容量瓶中加蒸馏水,至液面距刻度线1-2cm处;
③将烧杯中的溶液沿玻璃棒注入容量瓶中;
④在烧杯中加入少量的蒸馏水,洗涤烧杯内壁和玻璃棒2-3次后移入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;
⑤改用胶头滴管加水至刻度线,盖好瓶塞,反复上下颠倒,摇匀。
正确的操作顺序为__________________(填序号)
(4)上述操作⑤中,如果不小心加水超过刻度线,处理方法是_______________
(5)下列操作会导致所配硫酸铜溶液物质的量浓度偏低的是_______(填序号)
①在烧杯中搅拌溶液时,有少量液体溅出
②定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线
③容量瓶洗净后残留少量蒸馏水
④所使用的容量瓶刚用某种浓度的硫酸铜溶液润洗过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的化工原料,以丙烯为原料制取乳酸(![]() )的流程如下(部分反应的条件已略去)。
)的流程如下(部分反应的条件已略去)。
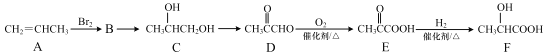
(1)B 的结构简式是_______。
(2)B→C 所需的反应物及反应条件分别是______。
(3)写出 C→D 的反应方程式_______。
(4)E→F 的反应类型是_______反应。
(5)丙烯可通过加聚反应制取聚丙烯塑料,写出聚丙烯的结构简式:_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从有机化合物 A 出发,在一定条件下,可发生如下图一系列转化(部分反应的条件已略去):
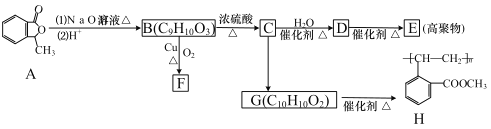
已知:B、D 互为同分异构体。
(1)B 的结构简式是_________。
(2)B→C 的反应类型是 ______。
(3)G 中官能团名称_________。
(4)D→E 反应的化学方程式为_______。
(5)写出同时满足下列条件的 C 的一种同分异构体的结构简式:__________。
①能发生银镜反应但不能水解;②苯环上的一氯代物只有两种。
(6)已知:![]() ,(R、R’可以是烃基或H),写出以
,(R、R’可以是烃基或H),写出以![]() 为原料合成“物质 A”的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______
为原料合成“物质 A”的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是一种重要的化工原料,也是一种重要的溶剂。请回答下列问题:
(1)把苯加入到盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,出现橙红色液体的一层在________(填“上”或“下”)层。
(2)把苯加入到盛有少量酸性高锰酸钾溶液的试管中,振荡后,酸性高锰酸钾溶液不褪色,说明苯分子中________(填“有”或“没有”)碳碳双键。
(3)在浓硫酸作用下,苯在水浴加热时可以与浓硝酸反应生成硝基苯,该反应的化学方程式为__。
(4)苯在一定条件下生成溴苯的化学方程式为_______________。
(5)苯在一定条件下生成环己烷的方程式为__________________。
(6)乙烯与水的化学方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com