
����Ŀ���������(NH4ClO4)����������ƽ����ȡ��Ʊ�NH4ClO4�Ĺ����������£�
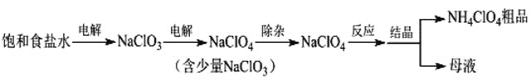
(1)���NaClO3��Һʱ��ClO3-��____��������Ӧ����缫��ӦʽΪ____��
(2)�������������ַ�����
�ٷ���1�����������H2O2��Һ��NaClO3ת��ΪClO2����ѧ����ʽΪ______��
����2�����백ˮ��FeCl24H2O��NaClO3ת��ΪCl-�����ӷ���ʽΪ____�����FeCl24H2O��������ֺ�ɫ���Գ������ó���������______��(�ѧʽ)
�ڱȽ������ԣ�ClO3-_____ClO4-(����>������<��)��
�����ַ�����ȣ�����1���ŵ���____��(��һ������)
(3)����Ӧ��ʱ��NaClO4��NH4Cl��90���Ʊ�NH4ClO4�������Ũ�����Һ������NH4Cl����������ȣ�ԭ����____��
(4)�������п�ѭ�����õ�������_________��(�ѧʽ)
���𰸡��� ClO3-+H2O-2e- =ClO4-+2H+ 2NaClO3+2HCl+H2O2=2ClO2��+2NaCl+2H2O+O2�� 6Fe2++ClO3-+3H2O+12NH3H2O=6Fe(OH)3��+Cl-+12NH4+ Fe3O4 ![]() ���������(�������H2O2�׳�ȥ�Ⱥ�����) Ũ�����Һ���ķ�ӦΪ���ȷ�Ӧ NaCl
���������(�������H2O2�׳�ȥ�Ⱥ�����) Ũ�����Һ���ķ�ӦΪ���ȷ�Ӧ NaCl
��������
(1)��������ӻ��ϼ�Ϊ+5�����ߵ�����������ӵ�+7�ۣ�����������Ӧ��Ϊ������Ӧ��
(2)��˫��ˮ�������ƻ�ԭΪ�������ȣ���ˮ���������ӡ���������ӷ�Ӧ���������ӡ���������������笠����ӣ����FeCl24H2O��������ֺ�ɫ���Գ���������������
�ڸ������Ϸ�������������������Դ��ڸ���������ӣ�
�۷���1���ŵ��Dz��������
(3)Ũ�����Һ��Ϊ���ȷ�Ӧ��
(4)���������жϡ�
(1)��������ӻ��ϼ�Ϊ+5�����ߵ�����������ӵ�+7�ۣ�����������Ӧ��������������Ӧ����ӦʽΪ��ClO3-+H2O-2e- =ClO4-+2H+��
(2)��˫��ˮ�������ƻ�ԭΪ�������ȣ�����ʽΪ��2NaClO3+2HCl+H2O2=2ClO2��+2NaCl +2H2O+O2������ˮ���������ӡ���������ӷ�Ӧ���������ӡ���������������笠����ӣ����ӷ���ʽΪ��6Fe2++ClO3-+3H2O+12NH3H2O=6Fe(OH)3��+Cl-+12NH4+�����FeCl24H2O��������ֺ�ɫ���Գ������ó���������������������
�ڸ������Ϸ�������������������Դ��ڸ���������ӣ�
�����ַ�����ȣ�����1���ŵ��Dz��������(�������H2O2�׳�ȥ�Ⱥ�����)��
(3)����Ũ�����Һ���ķ�ӦΪ���ȷ�Ӧ���ʷ�Ӧ������ȣ�
(4)�������̿�֪���������п�ѭ�����õ��������Ȼ��ơ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ������������������Ҫ��Ӧ�á��밴Ҫ��д����Ӧ�ķ���ʽ��
(1)ClO2��һ�ָ�Ч��ȫ��ɱ�����������Ȼ��Ƶ�ⷨ����ClO2����ԭ��ʾ��ͼ���£�
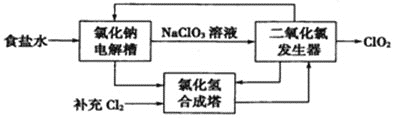
��д���Ȼ��Ƶ����ڷ�����Ӧ�����ӷ���ʽ��________________________��
��д��ClO2�������еĻ�ѧ����ʽ�����������ת�Ƶķ�����Ŀ��_____________��
(2)�״�ȼ�ϵ���Dz��ò����缫�������乤��ԭ����ʾ��ͼ���£�
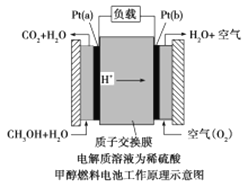
��ش��������⣺
Pt(a)�缫�ǵ�ص�_______�����缫��ӦʽΪ______________________��
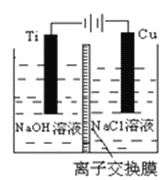
(3)�������������ӽ���Ĥ���Ƶ��Һ��OH-��Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ���õ�ص�������ӦʽΪ______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
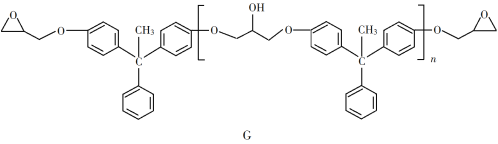
����Ŀ��������֬����������õĻ�е���ܡ���Ե�����Լ�����ֲ��ϵ�ճ�����ܣ��ѹ㷺Ӧ����Ϳ�Ϻͽ����������������Ʊ�һ�����ͻ�����֬G�ĺϳ�·�ߣ�
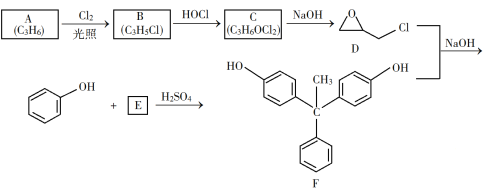
��֪������Ϣ��
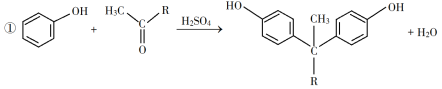
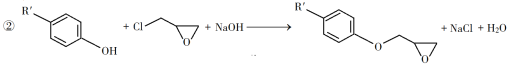
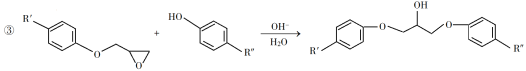
��1��A��һ��ϩ������ѧ����Ϊ__________��
��2����B����C�ķ�Ӧ����Ϊ__________��
��3����C����D�ķ�Ӧ����ʽΪ__________��
��4��E�Ľṹ��ʽΪ__________��
��5��E�Ķ��ȴ����ж���ͬ���칹�壬��д��������ͬʱ�������������ķ��㻯����Ľṹ��ʽ_____��_______��
���ܷ���������Ӧ�����˴Ź�������������壬�ҷ������Ϊ3��2��1��
��6�����軯����D��F��NaOHǡ����ȫ��Ӧ����1 mol��һ�ۺ϶ȵ�G�������ɵ�NaCl��H2O��������Ϊ765 g����G��nֵ������Ӧ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ��(�гֺ�β������װ����ʡ��)���е���Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ��ǣ� ��
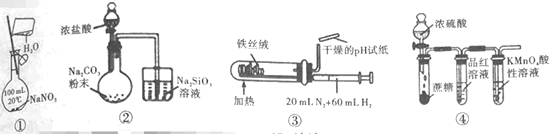
A.���â�װ�ã�����һ�����ʵ���Ũ�ȵ�NaNO3��Һ
B.���â�װ�ã���֤Ԫ�صķǽ����ԣ�Cl>C>Si
C.���â�װ�ã��ϳɰ������鰱������
D.���â�װ�ã���֤ŨH2SO4������ˮ�ԡ�ǿ�����ԣ�SO2����Ư���ԡ���ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧϰ�У�ͬѧ������������пƬ��ͭƬ�����ߡ������ơ�����֭��������̽��ԭ��ص���ɣ����н��۲���ȷ����
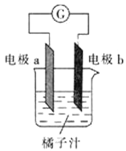
A.��aΪ��Ƭ��bΪпƬ��ͭƬ��������һ����������
B.��aΪпƬ��bΪ��Ƭ����b���ϵĵ缫��ӦʽΪ![]()
C.ԭ����ǽ���ѧ��ת��Ϊ���ܵ�װ��
D.��a��b��Ϊ��Ƭ���������ָ�벻ƫת
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.ij C3H6 ������ֻ��һ���⣬˵�����л���Ϊ��ϩ
B.��ϩ��ʹ��ˮ��ɫ��˵����ϩ����Ư����
C.���������������ӳɷ�Ӧ��˵���������к���̼̼˫��
D.�ױ����γ� 2,4,6-�������ױ����������γ� 1,3,5-����������˵�����Ա�����Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˾ƥ��(����ˮ���ᣬ )��������Ӧ����㷺�Ľ��ȡ���ʹ�Ϳ���ҩ������ˮ���������ֽ⣬�ֽ��¶�Ϊ128�桫135�档ijѧϰС����ʵ������ˮ����(���ǻ�������)�������[(CH3CO)2O]Ϊ��Ҫԭ�Ϻϳɰ�˾ƥ�֣���Ӧԭ�����£�
)��������Ӧ����㷺�Ľ��ȡ���ʹ�Ϳ���ҩ������ˮ���������ֽ⣬�ֽ��¶�Ϊ128�桫135�档ijѧϰС����ʵ������ˮ����(���ǻ�������)�������[(CH3CO)2O]Ϊ��Ҫԭ�Ϻϳɰ�˾ƥ�֣���Ӧԭ�����£�
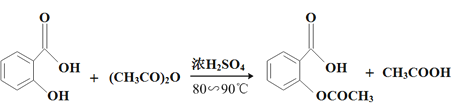
�Ʊ����������������£�

��Ҫ�Լ��Ͳ�Ʒ�������������±���ʾ��
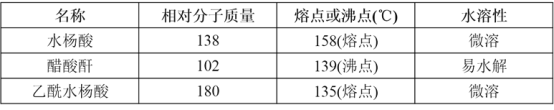
�����������Ϣ�ش��������⣺
��1���Ʊ���˾ƥ��ʱ��Ҫʹ�ø����������ԭ����___��
��2���ϳɰ�˾ƥ��ʱ������ʵļ��ȷ�����___��
��3���ᴿ�ֲ�Ʒ�������£����Ȼ���װ����ͼ��


��ʹ���¶ȼƵ�Ŀ���ǿ��Ƽ��ȵ��¶ȣ���ֹ___��
������ˮ������������___(�a����b��)��
�۳��ȹ��˵�ԭ����___��
������˵������ȷ����___(����ĸ)��
A.�����ᴿ�������������������������ܼ�
B.�����ᴿ�ֲ�Ʒ�ķ������ؽᾧ
C.���������ᴿ���̿��Եó���˾ƥ�������������е��ܽ�ȵ���ʱ��
D.��������ɫʯ����Һ�жϲ�Ʒ���Ƿ���δ��Ӧ���ˮ����
��4����ʵ����ԭ��������2.0gˮ���ᡢ5.0mL������(����1.08g/cm3)�����ճƵò�Ʒ����Ϊ2.2g������������ˮ����IJ���Ϊ___%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���2molA��2molB���������������ݻ�Ϊ2L��ij�ܱ������У��������·�Ӧ��3A(g)+B(g)![]() xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬����ʱ���D��C��Ũ�Ⱦ�Ϊ0.4mol/L������д���пհף�
xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬����ʱ���D��C��Ũ�Ⱦ�Ϊ0.4mol/L������д���пհף�
(1)xֵ����_____________��
(2)A��ת����Ϊ_______________��
(3)����D�ķ�Ӧ����Ϊ_____________��
(4)�������Ӧ��ϵ��ѹǿ����ƽ����ϵ��C���������� _________������С�䣩��
(5)�ڴ��¶��£��û�ѧ��Ӧ��ƽ�ⳣ��k=__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��Ϊ������Ԫ�أ�A�����ԭ��������С��Ԫ�أ�B��+1�������Ӻ�C�ĩ�1�������Ӷ�����ԭ�Ӿ�����ͬ�ĵ��Ӳ�ṹ��D��C����һ���ڣ�����B�γ�BD�����ӻ����E��CΪͬһ����Ԫ�أ�������������Ӧ��ˮ����Ϊһ��ǿ�ᡣ�����������Ϣ�ش��������⣺
��1��BԪ����Ԫ�����ڱ��е�λ���ǵ�______����______�壻
��2������CԪ�ص�ԭ�ӽṹʾ��ͼ______��
��3����E���⻯�������������������ȵķ�����______����һ�����ѧʽ����ͬ������������______��
��4��A��D�γɵĻ������к��л�ѧ����������_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com