
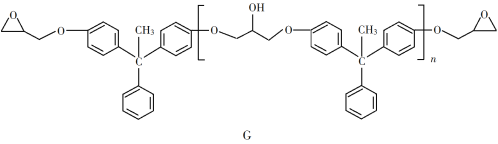
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:
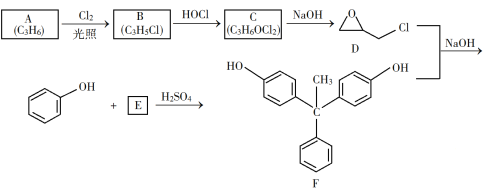
已知以下信息:
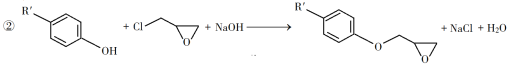
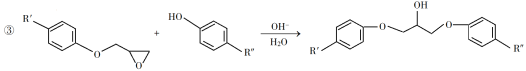
(1)A是一种烯烃,化学名称为__________。
(2)由B生成C的反应类型为__________。
(3)由C生成D的反应方程式为__________。
(4)E的结构简式为__________。
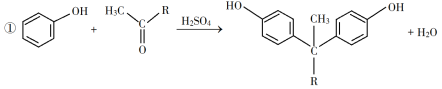
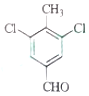
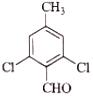
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式_____、_______。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H2O的总质量为765 g,则G的n值理论上应等于__________。
【答案】丙烯 加成反应 ClCH2CHOHCH2Cl+NaOH→![]() +NaCl+H2O(或CH2OHCHClCH2Cl+NaOH→
+NaCl+H2O(或CH2OHCHClCH2Cl+NaOH→![]() +NaCl+H2O)
+NaCl+H2O) 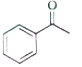
 8
8
【解析】
A是一种烯烃,应为CH3CH=CH2,光照条件下发生取代反应生成B为ClCH2CH=CH2,根据C的化学式可知,B与HOCl发生加成反应生成C,C为ClCH2CHOHCH2Cl或CH2OHCHClCH2Cl;由信息①可知E应为 ;D、F发生信息②和③的反应生成G,据此分析解答。
;D、F发生信息②和③的反应生成G,据此分析解答。
(1)由以上分析可知A为丙烯,故答案为:丙烯;
(2)B为ClCH2CH=CH2,根据C的化学式可知,B与HOCl发生加成反应生成C,故答案为:加成反应;
(3) C为ClCH2CHOHCH2Cl或CH2OHCHClCH2Cl,由C生成D的反应方程式为ClCH2CHOHCH2Cl+NaOH→![]() +NaCl+H2O或CH2OHCHClCH2Cl+NaOH→
+NaCl+H2O或CH2OHCHClCH2Cl+NaOH→![]() +NaCl+H2O,故答案为:ClCH2CHOHCH2Cl+NaOH→
+NaCl+H2O,故答案为:ClCH2CHOHCH2Cl+NaOH→![]() +NaCl+H2O(或CH2OHCHClCH2Cl+NaOH→
+NaCl+H2O(或CH2OHCHClCH2Cl+NaOH→![]() +NaCl+H2O);
+NaCl+H2O);
(4)根据上述分析,E的结构简式为 ,故答案为:
,故答案为: ;
;
(5)E为 ,E的二氯代物有多种同分异构体,①能发生银镜反应,说明分子中含有醛基;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1,则应含有1个甲基,且结构对称,应为
,E的二氯代物有多种同分异构体,①能发生银镜反应,说明分子中含有醛基;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1,则应含有1个甲基,且结构对称,应为 、
、 ,故答案为:
,故答案为: 、
、 ;
;
(6)由方程式可知生成NaCl和H2O的物质的量相等,若生成的NaCl和H2O的总质量为765g,则二者的物质的量分别为 =10mol,则需要9molF、10molD参加反应,由G的结构简式可知n=8,故答案为:8。
=10mol,则需要9molF、10molD参加反应,由G的结构简式可知n=8,故答案为:8。


科目:高中化学 来源: 题型:
【题目】关于一些重要的化学概念有下列说法,其中正确的是( )
①Fe(OH)3胶体和CuSO4溶液都是混合物 ②BaSO4是一种难溶于水的强电解质 ③冰醋酸、纯碱、小苏打分别属于酸、碱、盐 ④煤的干馏、煤的气化和液化都属于化学变化 ⑤置换反应都属于离子反应
A.①②⑤B.①②④C.②③④D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列有关含氮物质的问题:
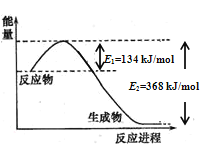
(1)图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______________________________________________;
恒温恒容条件下,不能说明该反应已达到平衡状态的是________![]() 填序号
填序号![]() 。
。
A.容器内混合气体颜色不再变化 ![]() 容器内的压强保持不变
容器内的压强保持不变
C.v逆(NO2)=v正(NO) ![]() 容器内混合气体密度保持不变
容器内混合气体密度保持不变
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)2NO(g) H>0,已知该反应在2404℃时,平衡常数K=64×10-4。
该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应的正反应速率和逆反应速率的关系:v正_____v逆(填“>”、“<”或“=”)。
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。总电池反应为N2H4+O2=N2+2H2O。该电池放电时,负极的电极反应式是______________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适序号填写在空格上。同位素__;同一个物质__;同分异构体__;同素异形体__。
①金刚石与石墨;②D与T;③12C和13C;④O2与O3;⑤CH4和CH3-CH2-CH3;⑥CH2=CHCH3和CH2=CH2;⑦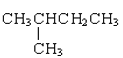 和CH3-CH2-CH2-CH2-CH3;⑧
和CH3-CH2-CH2-CH2-CH3;⑧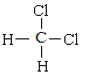 和
和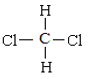
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料在疫情防控和治疗中起到了重要的作用。下列说法正确的是
A.聚乙烯是生产隔离衣的主要材料,能使酸性高锰酸钾溶液褪色
B.聚丙烯酸树脂是3D打印护目镜镜框材料的成分之一,可以与NaOH溶液反应
C.天然橡胶是制作医用无菌橡胶手套的原料,它是异戊二烯发生缩聚反应的产物
D.聚乙二醇可用于制备治疗新冠病毒的药物,聚乙二醇的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法错误的是( )
A.1L0.2mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.2NA
B.H2O2+Cl2=2HCl+O2反应中,每生成32gO2,转移2NA个电子
C.3.6gCO和N2的混合气体含质子数为1.8NA
D.常温常压下,30g乙烷气体中所含共价键的数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物燃料电池进行废水处理,可实现碳氮联合转化。某微生物燃料电池的工作原理如图所示,其中M、N为厌氧微生物电极。下列有关叙述错误的是

A.负极反应式为![]()
B.电池工作时,![]() 由M极区移向N极区
由M极区移向N极区
C.相同条件下,M极区生成的![]() 与N极区生成的
与N极区生成的![]() 的体积之比为
的体积之比为![]()
D.好氧微生物反应器中发生的反应的离子方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)可用作火箭推进剂等。制备NH4ClO4的工艺流程如下:
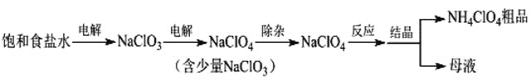
(1)电解NaClO3溶液时,ClO3-在____极发生反应,其电极反应式为____。
(2)“除杂”有两种方案。
①方案1:加入盐酸和H2O2溶液,NaClO3转化为ClO2,化学方程式为______。
方案2:加入氨水和FeCl24H2O,NaClO3转化为Cl-,离子方程式为____,如果FeCl24H2O过量会出现黑色磁性沉淀,该沉淀可能是______。(填化学式)
②比较氧化性:ClO3-_____ClO4-(填“>”或“<”)。
③两种方案相比,方案1的优点是____。(答一条即可)
(3)“反应”时用NaClO4和NH4Cl在90℃制备NH4ClO4。如果用浓盐酸和液氨代替NH4Cl,则无需加热,原因是____。
(4)该流程中可循环利用的物质是_________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从有机化合物 A 出发,在一定条件下,可发生如下图一系列转化(部分反应的条件已略去):
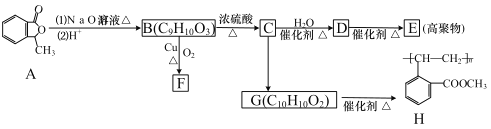
已知:B、D 互为同分异构体。
(1)B 的结构简式是_________。
(2)B→C 的反应类型是 ______。
(3)G 中官能团名称_________。
(4)D→E 反应的化学方程式为_______。
(5)写出同时满足下列条件的 C 的一种同分异构体的结构简式:__________。
①能发生银镜反应但不能水解;②苯环上的一氯代物只有两种。
(6)已知:![]() ,(R、R’可以是烃基或H),写出以
,(R、R’可以是烃基或H),写出以![]() 为原料合成“物质 A”的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______
为原料合成“物质 A”的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com