
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足右图所示转化关系的是

甲 | 乙 | 丙 | 戊 | |
A | NH3 | Cl2 | N2 | H2 |
B | C | SiO2 | CO | CuO |
C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | CO2 |
D | 乙醇乙酯 | NaOH溶液 | 乙醇 | 乙酸 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】有关键能(破坏1mol共价键吸收的能量)数据如表
化学键 | Si-O | O=O | Si-Si |
键能/kJmol-1 | X | 498.8 | 176 |
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)△H=-989.2kJmol-1,则X的值为( )
(已知1molSi中含有2molSi-Si键,1molSiO2中含有4molSi-O键)
A. 460 B. 423.3 C. 832 D. 920
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁。现用如图所示的装置模拟上述过程进行实验。

(1)写出仪器的名称:a_______,b________。
(2)A中反应的化学方程式为________。C中反应的化学方程式为________。
(3)装置B中加入的试剂是________。
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁。为防止有杂质FeCl2生成,可在装置__和__(填字母)间增加一个盛有________的洗气瓶。
(5)装置D的作用是________。为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:________。
(6)反应结束后,取少量装置C中的固体于试管中,加入足量盐酸,固体完全溶解,得到溶液X。证明溶液X中含有FeCl3的试剂是________,观察到的现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+2D(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol。请计算:
3C(g)+2D(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol。请计算:
(1)5min末A的物质的量浓度___________________;
(2)5min内D的平均化学反应速率____________________;
(3)B的转化率_____________________________;
(4)反应后容器中的总压强与反应前总压强之比为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)每消耗8g CH4转移的电子的数目为 。
(2)已知:①2CO(g)+O2(g)=2CO2(g) △H1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=ckJ·mol-1
④CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4
CO(g)+3H2(g) △H4
由此计算△H4= kJ·mol-1。
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
①0~tmin内,该反应的平均反应速率v(H2)= 。②T℃时,该反应的平衡常数K= 。
③当温度升高到(T+100)℃时,容器中c(CO)="0.75" mol·L-1,则该反应是 反应(填“吸热”或“放热”)。
(4)已知熔融碳酸盐燃料电池的工作原理示意图如下:

①放电过程中K+和Na+向电极 (填“A”或“B”)移动。
②该电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学拟分析某市空气的质量情况,测定该市空气中SO2的含量并制定下列研究方案:
Ⅰ.资料表明,SO2具有较强的还原性,能与高锰酸钾酸性溶液发生反应:5SO2+2![]() +2H2O===5
+2H2O===5![]() +2Mn2++4H+。
+2Mn2++4H+。
Ⅱ.设计实验方案:利用SO2的还原性使SO2和已知浓度及体积的高锰酸钾酸性溶液反应。
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽。
Ⅳ.选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后。
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议。
(1)该小组同学拟用如图所示装置定量分析空气中SO2的含量。
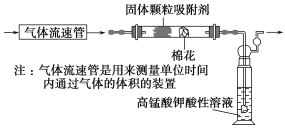
①通入空气前应进行的实验操作是________________________________;
②当观察到实验的现象为________________________________________时,应停止通空气;
③实验过程中需测量并记录的数据是_________________________________。
(2)如图表示该小组同学根据实验测得的该市不同地区空气中SO2的含量。
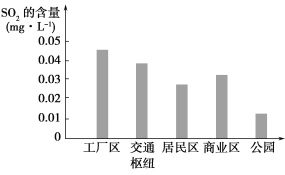
①工厂区、交通枢纽SO2含量明显高于其他地区的原因是_____________;
②请向当地有关部门提出一条减少工厂区SO2排放的建议:__________________________。
(3)下表是该小组同学测得的不同天气情况下的城市空气中SO2的平均含量。请分析雨后或风速较大时SO2平均含量较低的原因:
天气情况 | 平均风速(m·s1) | 空气中SO2的平均含量(mg·L1) |
雨前 | 2.0 | 0.03 |
雨后 | 2.2 | 0.01 |
晴 | 23 | 0.015 |
晴 | 0.9 | 0.03 |
①_____________________________________________________;
②_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓝色电解质溶液中,只可能大量存在有H+、Cu2+、CO32-、OH-、Cl-等离子,你认为一定有的离子是______________,一定没有的离子是_____________,还需进一步确认的_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答:

(1)实验室制备氨气的化学方程式为__________。
(2)用装置B收集氨气时,应选择氨气的进气口是_____(选填“a”或“b”),并说明选择的理由是___________。
(3)打开装置B中的止水夹c,若观察到圆底烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________,_________。
(4)为防止污染环境,以下装置(盛放的液体均为水)可用于吸收多余氨气的是_____(填序号)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com