
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相等(不考虑水解),且SO42﹣的物质的量浓度为9mol/L,则此溶液最多溶解Mg的质量为( )
|
| A. | 24g | B. | 18g | C. | 21.6g | D. | 14.4g |
| 化学方程式的有关计算.. | |
| 专题: | 计算题. |
| 分析: | 足量的Mg与CuSO4、Fe2(SO4)3、H2SO4的混合溶液反应最终得到MgSO4,由元素守恒可知,可知n(Mg)=n(MgSO4)=n(SO42﹣),再根据m=nM计算Mg的质量. |
| 解答: | 解:足量的Mg与CuSO4、Fe2(SO4)3、H2SO4的混合溶液反应最终得到MgSO4,由元素守恒可知,可知n(Mg)=n(MgSO4)=n(SO42﹣)=0.1L×9mol/L=0.9mol,故最多溶解Mg的质量=0.9mol×24g/mol=21.6g,故选C. |
| 点评: | 本题考查化学方程式有关计算,难度中等,关键是明确足量的Mg与硫酸铁反应得到Fe,注意利用守恒思想解答,简化计算步骤. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白。过氧化氢法生产亚氯酸钠的流程图如下
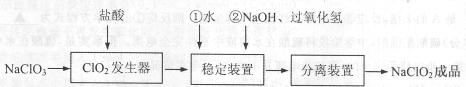
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为
(2)在NaClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂 B.还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验后顺序填写操作代号)。
A.过滤 B.加热 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当pH≤2.0时,ClO-2能被I完全还原成Cl—;
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6。
欲测定成品中NaClO2的含量,现进行如下操作:

①步骤Ⅱ中发生反应的离子方程式是 ,
步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数 (用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
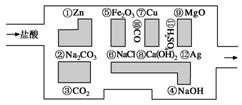
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线):_____________________________________________
________________________________________________________________________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有________个,其中能“吃掉”盐酸的盐是________,写出该反应的化学方程式_____________________________
________________________________________________________________________。
(3)在不能与盐酸反应的物质中,属于氧化物的是________(填写物质序号,下同),属于单质的是________。
(4)如果将盐酸换成氧气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
人造空气(氧气O2与氦气He的混合气)可用于减轻某些病痛或供深水潜水员使用.在标准状况下,5.6L“人造空气”的质量是2.4g,其中氧气与氦气的质量比是( )
|
| A. | 1:1 | B. | 1:4 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
向硫酸铜溶液中加入一小块金属钠后,观察到的现象有( )
①钠浮于液面上
②熔化成小球
③发出嘶嘶的响声,放出气体
④钠周围蓝色沉淀部分变黑
⑤有蓝色沉淀产生
⑥析出大量红色的铜
⑦小球在溶液中沉浮
⑧小球在液面上游动、逐渐变小,直至消失.
|
| A. | ①②③④⑤⑥ | B. | ①②③④⑤⑧ | C. | ①②③⑥⑧ | D. | ②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)氢化钠(NaH)为白色晶体,其中H﹣有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价,写出其化学反应方程式,并用单线桥标出电子的转移与数目  ;
;
NaH能与水剧烈反应NaH+H2O═NaOH+H2↑,NaH与液氨也有类似反应,写出反应方程式 NaH+NH3═NaNH2+H2 .
(2)有一表面被部分氧化为氧化钠的金属钠试样,欲测其钠的纯度.通过实验可得到下列数据:
①试样的质量为m1g;②水的质量(过量)为m2g;③与水反应过程中生成H2的质量为m3g.
a、求试样钠的纯度,不可能用到的数据是 ② (填数据代号).
b、请根据能测定钠纯度的组合数据,写出计算钠纯度的数学表达式: 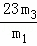 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
理论上不能用于设计成原电池的反应是
A. 2H2(g)+O2(g)==2H2O(l) △H<0 B. HCl(aq)+NaOH(aq)==NaCl(aq)+H2O(l) △H<0
C. 2Al(s)+3Cl2(g)==2AlCl3(s) △H<0 D. Zn(s)+2HCl(aq)==ZnCl2+H2(g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
银锌电池广泛用于各种电子仪器的电源,它的充放电过程可表示为:2Ag+Zn(OH)2 Ag2O+Zn+H2O回答下列有关问题。
电池的放电过程是 (填“①”或“②”)。
)该电池属于 性电池(填“酸”、“碱”或“中”)。
写出充电时阳极的电极反应式:
充电时,电池的正极应接电源的 极。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.11.2L氧气所含的原子数为NA
B.1.9g的H3O+离子中含有的电子数为11NA
C.常温常压下96g NO2与N2O4的混合物含有的氧原子数为2NA
D.0.5mol/LH2SO4中的H+数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com