
银锌电池广泛用于各种电子仪器的电源,它的充放电过程可表示为:2Ag+Zn(OH)2 Ag2O+Zn+H2O回答下列有关问题。
电池的放电过程是 (填“①”或“②”)。
)该电池属于 性电池(填“酸”、“碱”或“中”)。
写出充电时阳极的电极反应式:
充电时,电池的正极应接电源的 极。
 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相等(不考虑水解),且SO42﹣的物质的量浓度为9mol/L,则此溶液最多溶解Mg的质量为( )
|
| A. | 24g | B. | 18g | C. | 21.6g | D. | 14.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1×lO5 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+ 1/2O2 (g)△H=+242 kJ.mol-1 B. 2H2(g)+O2(g)=2H2O(l) △H= -484 kJ.mol-l
C. H2(g)+ 1/2O2(g)=H2O(g) △H=+242 kJ.mol-l D. 2H2(g) + O2(g) = 2 H2O(g) △H= -484 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式 (i) I2 (g)+ H2(g)  2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
(ii) I2(S)+ H2(g) 2HI(g) ΔH=+26.48 kJ/mol. 下列判断正确的是
2HI(g) ΔH=+26.48 kJ/mol. 下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜
B.标准状况下,33.6 L三氧化硫中含有1.5 NA个三氧化硫分子
C.1mol Cl2与过量的铁反应,转移3NA个电子
D.1 mol FeCl3跟水反应,完全转化为氢氧化铁胶体后,其中胶体粒子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
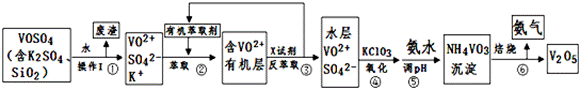 请回答下列问题:
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式)
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4 (水层)
2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 。
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
该工艺流程中,可以循环利用的物质有 和 。
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2与SO2都是酸性氧化物,具有一定的相似性。Na2O2和CO2能反应,某化学兴趣小组的同学据此认为Na2O2和SO2也能反应,为此设计了如下实验装置来验证Na2O2和SO2反应的产物。
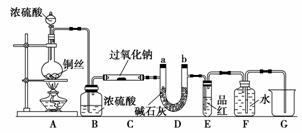
如图安装仪器,检查装置气密性后添加药品并滴入适量浓硫酸。回答下列问题:
(1)点燃A处酒精灯,不久可观察到烧瓶中产生大量气体,写出反应的化学方程式:____________________________;C处玻璃管管壁发热,管内药品的颜色变化是___________________________________________________________________。
(2)在反应过程中如何用较简便的操作证明反应产生了O2?____________________________________。
(3)E处用排水法收集气体,由什么现象可证明收集的气体中已不含SO3?________________________________________________________________________。
(4)待反应结束后,取C处玻璃管内的少量固体装入试管中,加水溶解时未产生气体,则如何证明产物中有Na2SO3?______________________________。
(5)待反应结束后,取C处玻璃管内的少量固体装入试管中,加入足量的盐酸,再加入氯化钡溶液,发现有白色沉淀生成,试分析产生沉淀的原因:________________________________________________________________________
________________________________________________________________________。
(6)有的同学认为:若将装置末端的烧杯换成量筒(或量气管),则可通过测定排水的体积来测定Na2O2药品的纯度。试判断该方案是否可行:________(填“是”或“否”),原因是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)
Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为QkJ
C.将反应的温度由T1升高至T2,则反应的平衡常数K1>K2
D.当反应吸热为0.25QkJ时,生成的HCl恰好与1 molNaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com