
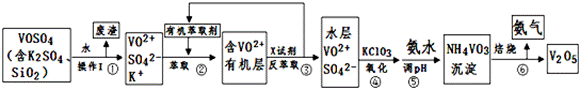
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
 请回答下列问题:
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式)
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4 (水层)
2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 。
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
该工艺流程中,可以循环利用的物质有 和 。
【知识点】物质分离和提纯的方法和基本操作综合应用;盐类水解的应用
【答案解析】(1)SiO2 (2)加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量等] , H2SO4
(3) 6VO2+ + ClO3- + 9H2O = 6VO3- ̄+ Cl- + 18H+
(4)1.7~1.8(或1.7、1.8其中一个),2.6×10-3mol•L-1
(5)氨气(或氨水);有机萃取剂
解析:(1)将VOSO4(含K2SO4、SiO2杂质)酸溶后,二氧化硅不与酸反应,过滤得到滤渣为二氧化硅;
(2)②中萃取时必须加入适量碱,分析平衡,Rn+(水层)+nHA(有机层)⇌RAn(有机层)+nH+(水层),加入的碱会和平衡中的氢离子反应促进平衡正向进行;③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行;
(3)④中氯酸钾将VO2+氧化成VO3- ̄,离子方程式为:
6VO2+ + ClO3- + 9H2O = 6VO3- ̄+ Cl- + 18H+
(4)根据表中数据判断,⑤中加入氨水,调节溶液pH最佳值为1.7~1.8,此时钡沉淀率达到最大,需要氨水量较小;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,此时PH=2,c(H+)=10-2mol/L,c(OH-)=10-12mol/L,则溶液中c(Fe3+)浓度依据溶度积计算,Ksp[Fe(OH)3]=
c(Fe3+)×c3(OH-)=2.6×10-39,计算得到c(Fe3+)=2.6×10-3mol/L,不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3mol/L;
(5)分析流程图,物质参加反应,反应过程中又生成的物质,或重复利用的物质可以循环利用,流程中有机萃取剂、氨气可以循环利用。
【思路点拨】本题考查了流程分析判断,物质性质和实验设计的方法应用,题干信息分析判断能力,掌握基础是关键,题目难度中等。


科目:高中化学 来源: 题型:
“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
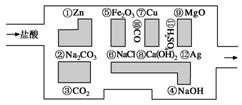
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线):_____________________________________________
________________________________________________________________________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有________个,其中能“吃掉”盐酸的盐是________,写出该反应的化学方程式_____________________________
________________________________________________________________________。
(3)在不能与盐酸反应的物质中,属于氧化物的是________(填写物质序号,下同),属于单质的是________。
(4)如果将盐酸换成氧气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
理论上不能用于设计成原电池的反应是
A. 2H2(g)+O2(g)==2H2O(l) △H<0 B. HCl(aq)+NaOH(aq)==NaCl(aq)+H2O(l) △H<0
C. 2Al(s)+3Cl2(g)==2AlCl3(s) △H<0 D. Zn(s)+2HCl(aq)==ZnCl2+H2(g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
银锌电池广泛用于各种电子仪器的电源,它的充放电过程可表示为:2Ag+Zn(OH)2 Ag2O+Zn+H2O回答下列有关问题。
电池的放电过程是 (填“①”或“②”)。
)该电池属于 性电池(填“酸”、“碱”或“中”)。
写出充电时阳极的电极反应式:
充电时,电池的正极应接电源的 极。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 溴乙烷与氢氧化钠溶液共热后加入硝酸银溶液 | 无浅黄色沉淀出现 | 溴乙烷未水解 |
| B | 向某溶液中先滴加氯水,再滴加少量KSCN溶液。 | 溶液变成血红色 | 溶液中含有Fe2+ |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向盛有碘水的试管中加入CCl4后充分振荡静置 | 液体分层,上层基本无色,下层紫红色 | 碘在CCl4中的溶解度较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
取一小块金属钠放在燃烧匙里加热,下列对实验现象的描述正确的是( )
①金属钠熔化 ②在空气中燃烧,火焰为紫色 ③燃烧后得到白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体物质
A.①② B.①②③
C.①④⑤ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是( )
A.Na2O B.Na2O2
C.Na2O和Na2O2 D.Na2O2和NaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.11.2L氧气所含的原子数为NA
B.1.9g的H3O+离子中含有的电子数为11NA
C.常温常压下96g NO2与N2O4的混合物含有的氧原子数为2NA
D.0.5mol/LH2SO4中的H+数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
高炉炼铁过程中发生的主要反应为
Fe2O3(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1 000[学+科 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ,ΔH (填“>”“<”或“=”)0。
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)= 、CO的平衡转化率= 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 。
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com