
设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.11.2L氧气所含的原子数为NA
B.1.9g的H3O+离子中含有的电子数为11NA
C.常温常压下96g NO2与N2O4的混合物含有的氧原子数为2NA
D.0.5mol/LH2SO4中的H+数为NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相等(不考虑水解),且SO42﹣的物质的量浓度为9mol/L,则此溶液最多溶解Mg的质量为( )
|
| A. | 24g | B. | 18g | C. | 21.6g | D. | 14.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
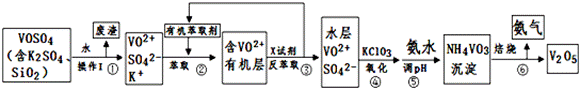 请回答下列问题:
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式)
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4 (水层)
2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 。
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
该工艺流程中,可以循环利用的物质有 和 。
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2与SO2都是酸性氧化物,具有一定的相似性。Na2O2和CO2能反应,某化学兴趣小组的同学据此认为Na2O2和SO2也能反应,为此设计了如下实验装置来验证Na2O2和SO2反应的产物。
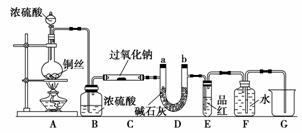
如图安装仪器,检查装置气密性后添加药品并滴入适量浓硫酸。回答下列问题:
(1)点燃A处酒精灯,不久可观察到烧瓶中产生大量气体,写出反应的化学方程式:____________________________;C处玻璃管管壁发热,管内药品的颜色变化是___________________________________________________________________。
(2)在反应过程中如何用较简便的操作证明反应产生了O2?____________________________________。
(3)E处用排水法收集气体,由什么现象可证明收集的气体中已不含SO3?________________________________________________________________________。
(4)待反应结束后,取C处玻璃管内的少量固体装入试管中,加水溶解时未产生气体,则如何证明产物中有Na2SO3?______________________________。
(5)待反应结束后,取C处玻璃管内的少量固体装入试管中,加入足量的盐酸,再加入氯化钡溶液,发现有白色沉淀生成,试分析产生沉淀的原因:________________________________________________________________________
________________________________________________________________________。
(6)有的同学认为:若将装置末端的烧杯换成量筒(或量气管),则可通过测定排水的体积来测定Na2O2药品的纯度。试判断该方案是否可行:________(填“是”或“否”),原因是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧化铁胶体和氯化铁溶液共同具备的性质是
A.都是较稳定的红褐色液体 B. 加入盐酸后,先产生沉淀,随后沉淀溶解
C. 都有丁达尔现象 D.分散质微粒都可通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
H-是负一价的阴离子,它可与NH3发生以下反应:H-+NH3= H2+NH2-,下列有关这个反应的说法中不正确的是
A. 该反应中NH3被还原 B.该反应中H-是还原剂
C.该反应中NH2-是还原产物 D.反应中被氧化和被还原的元素都是H元素
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现有以下物质:①NaCl晶体 ②干冰 ③液态的醋酸 ④铜 ⑤BaSO4固体⑥蔗糖⑦酒精 ⑧熔融的KNO3 ⑨浓HNO3 回答下列问题(填序号)以上物质能导电的是_________________________________;
以上物质属于非电解质的是___________________________;
以上物质属于电解质的是________________________ ___;
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)
Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为QkJ
C.将反应的温度由T1升高至T2,则反应的平衡常数K1>K2
D.当反应吸热为0.25QkJ时,生成的HCl恰好与1 molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
银氨溶液可用于检测CO气体,实验室研究的装置如图:
|
| 已知:银氨溶液制备反应为 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O。 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 (填“强氧化性”或“脱水性”)。
(2)装置A中软管的作用是 。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润
红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是 。
②根据上述实验现象判断,上层清液中产物成分为 (填化学符号)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl
中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应 。
②若该反应中消耗6.6 g羟氨,理论上可得银的质量为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com