
高炉炼铁过程中发生的主要反应为
Fe2O3(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1 000[学+科 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ,ΔH (填“>”“<”或“=”)0。
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)= 、CO的平衡转化率= 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 。
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
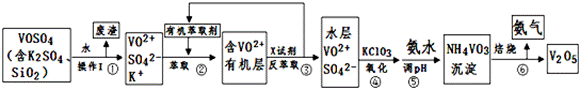 请回答下列问题:
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式)
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4 (水层)
2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 。
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
该工艺流程中,可以循环利用的物质有 和 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现有以下物质:①NaCl晶体 ②干冰 ③液态的醋酸 ④铜 ⑤BaSO4固体⑥蔗糖⑦酒精 ⑧熔融的KNO3 ⑨浓HNO3 回答下列问题(填序号)以上物质能导电的是_________________________________;
以上物质属于非电解质的是___________________________;
以上物质属于电解质的是________________________ ___;
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)
Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为QkJ
C.将反应的温度由T1升高至T2,则反应的平衡常数K1>K2
D.当反应吸热为0.25QkJ时,生成的HCl恰好与1 molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,不能用平衡移动原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氟酸(HF)是一种弱酸。25℃时,向20mLO.1mol•L-1氢氟酸中加入VmL0.1mol•L-1NaOH溶液充分反应。已知: HF(aq)+OH-(aq)═F-(aq)+H2O(1) △H= - 67.7kJ•mol-1,
H+(aq)+OH-(aq)═H2O (1) △H═ - 57.3kJ•mol- 根据题意,下列判断或结论正确的是
A.氢氟酸的电离过程是吸热的
B.当V=20时,溶液中:c(F-)<c(Na+)=0.1mol•L-1
C.当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-)
D.当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
在带有活塞的密闭容器中发生反应:Fe2O3+3H2===2Fe+3H2O(g),采取下列措施能改变反应速率的是( )
A.增加Fe2O3的量 B.保持容器体积不变,增加H2输入量
C.减少Fe的量 D.保持容器体积不变,增加H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
银氨溶液可用于检测CO气体,实验室研究的装置如图:
|
| 已知:银氨溶液制备反应为 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O。 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 (填“强氧化性”或“脱水性”)。
(2)装置A中软管的作用是 。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润
红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是 。
②根据上述实验现象判断,上层清液中产物成分为 (填化学符号)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl
中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应 。
②若该反应中消耗6.6 g羟氨,理论上可得银的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
配制0.1mol/L盐酸溶液480mL,用量筒量取密度为1.19g/cm3质量分数为37%的浓盐酸约(取整数)( )mL注入烧杯中。用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中。
A 3.5 B 3.8 C 2.5 D 4.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com