
����Ŀ������Ҫ��ش���������:
��1������������������70��ʱ��Ӧ����������NaClO3��NaClO�����ʵ���֮��Ϊ3:1�����ӷ���ʽ_____________________________________________��
��2����ҵ�Ͽ���KClO3��Na2SO3��H2SO4�������Ƶ�ClO2���÷�Ӧ�������뻹ԭ�����ʵ���֮��Ϊ____��
��3��H3PO2��NaH2PO2���ɽ���Һ�е�Ag+��ԭΪ�����Ӷ������ڻ�ѧ����
��H3PO2�У�PԪ�صĻ��ϼ�Ϊ_______��
������H3PO2���л�ѧ������Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ4 :1������������Ϊ____(�ѧʽ)��
��4��ȡ300mL 0.2mol/L ��KI��Һ��һ����������KMnO4 ��Һǡ�÷�Ӧ�����ɵ����ʵ�����I2��KIO3��������KMnO4�����ʵ�������__________mol��
��5����Fe(NO3)3��Һ�м���Na2SO3��Һ����Һ�����ػ�ɫ��Ϊdz��ɫ����һ���ֱ�Ϊ�ػ�ɫ����Һ�ȱ�Ϊdz��ɫ�����ӷ���ʽ��_______________���ֱ�Ϊ�ػ�ɫ��ԭ����_________(�����ӷ���ʽ����)��
���𰸡� 10Cl2+20OH-![]() 16Cl-+C1O-+10H2O 2:1 +1 H3PO4 0.032 2Fe3++SO32-+H2O=2Fe2++SO42-+2H+ 3Fe2++4H++NO3-= 3Fe3++NO��+2H2O
16Cl-+C1O-+10H2O 2:1 +1 H3PO4 0.032 2Fe3++SO32-+H2O=2Fe2++SO42-+2H+ 3Fe2++4H++NO3-= 3Fe3++NO��+2H2O
����������1������������������70��ʱ��Ӧ����������NaClO3��NaClO�����ʵ���֮��Ϊ3�U1�����߾�����������仹ԭ�������Ȼ��ƣ����ݵ�ʧ�����غ��Լ�ԭ���غ��֪��Ӧ�����ӷ���ʽΪ��10Cl2+20OH-![]() 16Cl-+C1O-+10H2O���ʴ�Ϊ��10Cl2+20OH-
16Cl-+C1O-+10H2O���ʴ�Ϊ��10Cl2+20OH-![]() 16Cl-+C1O-+10H2O��
16Cl-+C1O-+10H2O��
��2��.��ҵ�Ͽ���KClO3��Na2SO3��H2SO4�������Ƶ�ClO2������Ԫ�صĻ��ϼ۽��ͣ�KClO3��������������Na2SO3����ԭ����SO32��������SO42�����ݵ�ʧ�����غ�͵���غ�ø÷�Ӧ�����ӷ���ʽΪ��2ClO3+SO32+2H+�T2ClO2+SO42+H2O�������ӷ�Ӧ��֪�÷�Ӧ���������뻹ԭ�����ʵ���֮��Ϊ2:1���ʴ�Ϊ��2:1��
��3��.��.��H3PO2�У���Ԫ��Ϊ+1�ۣ���Ԫ��Ϊ2�ۣ����ݻ��ϼ۴�����Ϊ0����PԪ�صĻ��ϼ�Ϊ+1�ۣ��ʴ�Ϊ��+1��
��.����H3PO2���л�ѧ������Ӧ������Ӧ��Ag+Ϊ��������H3PO2Ϊ��ԭ�����������뻹ԭ�������ʵ���֮��Ϊ4:1���������PԪ�صĻ��ϼ�Ϊx�����ݻ��ϼ�������ȿɵ�4��(10)=1��(x1)�����x=5��������������Ϊ+5�۵�H3PO4���ʴ�Ϊ��H3PO4��
��4��.n(KI)=0.06mol����һ����������KMnO4��Һǡ�÷�Ӧ�����ɵ����ʵ�����I2��KIO3����n(I2)=n(KIO3)=0.02mol����ʧȥ���ӵ����ʵ���Ϊ2��0.02mol+0.02mol��[5(1)]=0.16mol��������KMnO4�����ʵ�����0.16mol��(72)=0.032mol���ʴ�Ϊ��0.032��
��5��.Fe(NO3)3��Һ�м���Na2SO3��Һ����Һ�����ػ�ɫ��Ϊdz��ɫ����һ���ֱ�Ϊ�ػ�ɫ����Һ�ȱ�Ϊdz��ɫ��ԭ����Fe3+��SO32��������������Fe2+�����ӷ���ʽ��2Fe3++SO32+H2O�T2Fe2++SO42+2H+���ֱ�Ϊ�ػ�ɫ��ԭ����NO3��H+��Fe2+����������ԭ��Ӧ��������Fe3+�����ӷ���ʽΪ3Fe2++4H++NO3-= 3Fe3++NO��+2H2O���ʴ�Ϊ��2Fe3++SO32+H2O�T2Fe2++SO42+2H+��3Fe2++4H++NO3-= 3Fe3++NO��+2H2O.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ��ʾ�����ӵ���������ֵ������˵������ȷ����
��ʾ�����ӵ���������ֵ������˵������ȷ����
A. �ڳ��³�ѹ�£�11.2L����������ԭ����Ϊ![]()
B. 2.3g�����Ʊ�������Na2O2��ת�Ƶ�����Ϊ0.1![]()
C. 5.6g��������ϡ���ᷴӦת�Ƶĵ�����Ϊ0.3![]()
D. 2L 0.1 mol/LNa2SO4��Һ�к��е�Na+����Ϊ0.2![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ͭ���������Ǧ�����ʣ�ͨ����⾫��ͭ�������ຬ��Cu��Au���𣩺�PbSO4�����ʣ�Ϊ������õ����������͵��Һ��������¹������̣� 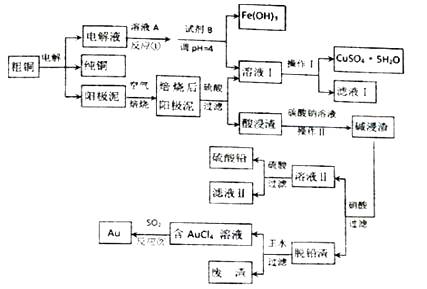
�ش��������⣺
��1����ҺA��һ����ɫ����������Ӧ�ٵ����ӷ���ʽΪ ��
��2���Լ�BΪ ��
��3������������ʱ��Ϊ����߱���Ч�ʣ���ȡ�ĺ�����ʩ����дһ�㼴�ɣ���
��4�����������Ҫ����Ϊ���ˣ�ϴ�ӣ�����
��5��д����Ӧ�ڵ����ӷ���ʽ ��
��6��Ϊ�˼��ٷ�Һ�ŷš��������������Դ����ҵ�Ͻ���Һ������Һ�����ѭ����������ָ������ͼ����һ�����Ƶ����� ��
��7����֪298Kʱ��Ksp��PbCO3��=1.46��10��13 �� Ksp��PbSO4��=1.2��10��8 �� �����ӷ���ʽ��ʾ����̼������Һ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ͭ�������A���ṹ��ͼ1������ش��������⣺ 
��1��Cu�ļ����Ų�ʽΪ ��
��2��A��������Ԫ��C��N��O�ĵ�һ�������ɴ�С��˳��Ϊ �� ���е�ԭ�ӵ��ӻ��������Ϊ
��3�����就���������H2NCH2COO�������ȷֽ�ɲ���CO2��N2 �� N2�ЦҼ��ͦм���Ŀ֮������N2O��CO2��Ϊ�ȵ����壬��N2O������Oֻ��һ��N��������N2O�ĵ���ʽΪ ��
��4����Cu���£��״��ɱ�����Ϊ��ȩ��HCHO������ȩ������HCO�ļ�����ѡ����ڡ��������ڡ���С�ڡ���120�㣻��ȩ����ˮ�γ����������ͼ2�б�ʾ���� ��
��5��������������ͼ3������ʯ�ṹ���ƣ��dz�Ӳ���ϣ���������������B��N��������ԭ����֮��Ϊ���ṹ��ѧ����ԭ�����������ʾ�����ڲ���ԭ�ӵ����λ�ã���ͼ4����������ľ����У�Bԭ�ӵ���������ֱ��У�B��0��0��0����B�� ![]() ��0��
��0�� ![]() ����B��
����B�� ![]() ��
�� ![]() ��0���ȣ��������������Bԭ������ҵȾ��Nԭ�ӵ��������Ϊ ��
��0���ȣ��������������Bԭ������ҵȾ��Nԭ�ӵ��������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���߷��Ӳ���PET������֬��PMMA�ĺϳ�·�����£� 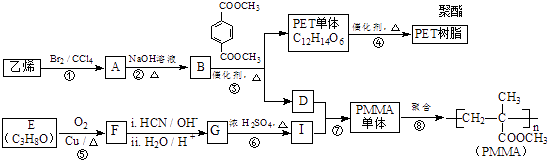
��֪��
��RCOOR��+R��18OH ![]() RCO18OR��+R��OH��R��R�䡢R�����������
RCO18OR��+R��OH��R��R�䡢R�����������
�� 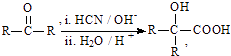 ��R��R�����������
��R��R�����������
��1���ٵķ�Ӧ������ ��
��2���ڵĻ�ѧ����ʽΪ ��
��3��PMMA����������������� ��
��4��F�ĺ˴Ź���������ʾֻ��һ��壬�ݵĻ�ѧ����ʽΪ ��
��5��G�Ľṹ��ʽΪ ��
��6������˵����ȷ����������ĸ��ţ��� a����Ϊ������Ӧ
b��B��D��Ϊͬϵ��
c��D�ķе��̼ͬԭ������������
d.1mol 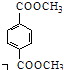 ������NaOH��Һ��Ӧʱ���������4molNaOH
������NaOH��Һ��Ӧʱ���������4molNaOH
��7��д����PET�����Ʊ�PET����������B�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£���������HCl������������е�NH3����������ԭ�Ӹ�����ȣ���ס��������������֮��Ϊ(����)
A. 2:1 B. 1:2 C. 1:1 D. 1:4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Զ�������Ϊԭ����ȡ������ؾ����ʵ��������ͼ�� 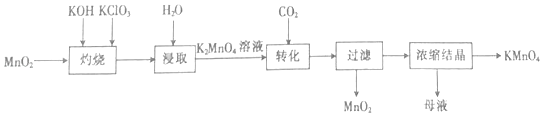
�����й�˵����ȷ���ǣ� ��
A.�����ա�ʱ�����ڲ��������н���
B.����ȡ��ʱ��������ˮ�Ҵ�����ˮ
C.��ת������Ӧ�У����������뻹ԭ��������ʵ���֮��Ϊ2��1
D.��Ũ���ᾧ�����ĸҺ��ֻ��KMnO4��K2CO3��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�飬�ܴﵽĿ���ǣ� �� 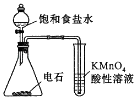
A.��ͼװ�ü�����Ȳ�Ļ�ԭ��
B.�ȼ�������ˮ��Ȼ���ټ������Ը��������Һ������ϩ���Ƿ���������ױ�
C.���ѻ����ʹ���ˮ����ȡ��
D.���������ͨ�����Ը��������Һ����ȥ�����л��е���ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ç������һ�ֺϳ�����������ҩ���Ƶ�ԭ�ϣ����������ƻ������ʯ���ֲ���У����й����������л��������˵����ȷ���ǣ� �� 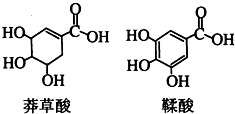
A.�����ᶼ������ˮ��Ӧ�ҷ�Ӧ��ԭ����ͬ
B.�����������Ȼ�����Һ����ɫ
C.���������ç���������ȶ�������̼̼˫��
D.�����ʵ����������������������Ʒ�Ӧ��������������ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com