
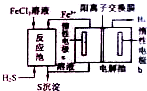
 ��ʯȼ�Ͽ��ɺͼӹ������г��������������ҵ�Ͽ���������ȡ������������ѧ��������Һ�������ӷ����Լ���
��ʯȼ�Ͽ��ɺͼӹ������г��������������ҵ�Ͽ���������ȡ������������ѧ��������Һ�������ӷ����Լ���| 1 |
| 2 |
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��| 1 |
| 2 |
c(H2)c
| ||
| c(H2S) |
c(H2)c
| ||
| c(H2S) |
| c2(H+)c(S2-) |
| c(H2S) |
| 1.2��10-15��0.9��10-7��0.1 |
| 0��32 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����������Դ���滯ʯȼ�ϣ������ڽ�Լ��Դ���������� |
| B��ʳƷ���Ӽ��������ƣ����DZ���һ��ͬϵ������Ӧ������ |
| C������ҩ������ܶ࣬��̼�����ơ�̼��ơ�̼��þ�������������� |
| D���Ҵ����ڿ�������Դ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������£���ӦCaCO3��s���TCaO��s��+CO2��g�������Է����У�˵���÷�Ӧ�ġ�H��0����S��0 |
| B������ʯ��ˮ�м�������CaO���ָ������º���Һ��pH���� |
| C��Na2CO3��Һ��ˮϡ�ͺָ���ԭ�¶ȣ���ҺpH��Kw����С |
| D����0��l mol?L-1��ϡ�����ˮϡ�͵Ĺ����У�c��H+����c��SO42-��ʼ��Ϊ2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
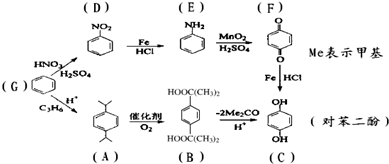
| A��G��D��D��E�ķ�Ӧ������ȡ����Ӧ |
| B��B�л����к��еĹ��������Ȼ� |
| C��G��A��A��B��������Ӧ����������ԭ�ӱ�100%���� |
| D���Ա����ӿ��Է���ȡ�����ӳɡ���ԭ�����������ۺ�ˮ�ⷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��c��OH-����c��H+����c��B+����c��A-�� |
| B��c��OH-��=c��H+��+c��HA�� |
| C��c��H+��+c��B+����c��A-��+c��OH-�� |
| D��c��A-��=c��B+����c��H+��=c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
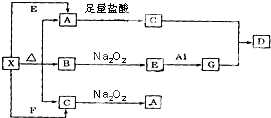 ��ͼ��ʾ�ķ�Ӧ��ϵ�У����ֲ��ﱻ��ȥ����֪��ɫ�����ĩX���ȷֽ⣬�ָ����������ɰ�ɫ����A����ɫҺ��B����ɫ����C��X��E��G����ɫ��Ӧ��Ϊ��ɫ��DΪ��ɫ������
��ͼ��ʾ�ķ�Ӧ��ϵ�У����ֲ��ﱻ��ȥ����֪��ɫ�����ĩX���ȷֽ⣬�ָ����������ɰ�ɫ����A����ɫҺ��B����ɫ����C��X��E��G����ɫ��Ӧ��Ϊ��ɫ��DΪ��ɫ�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com