
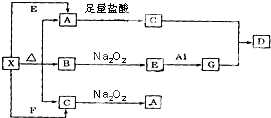
 如图表示的反应关系中,部分产物被略去.已知白色固体粉末X受热分解,恢复到室温生成白色固体A,无色液体B,无色气体C.X、E、G的焰色反应均为黄色,D为白色沉淀.
如图表示的反应关系中,部分产物被略去.已知白色固体粉末X受热分解,恢复到室温生成白色固体A,无色液体B,无色气体C.X、E、G的焰色反应均为黄色,D为白色沉淀.

科目:高中化学 来源: 题型:
| A、硫酸、纯碱、CaSO4 |
| B、HCl、烧碱、CuSO4 |
| C、HNO3、乙醇、氯化钠 |
| D、碳酸、CaO、苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
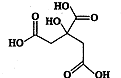 物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途.下列关于物质X的说法正确的是( )
物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途.下列关于物质X的说法正确的是( )| A、X的分子式为C6H7O7 |
| B、1 mol物质x最多可以和3 mol氢气发生加成反应 |
| C、X分子内所有原子均在同一平面内 |
| D、足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
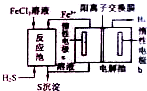 化石燃料开采和加工过程中常有硫化氢废气.工业上可用硫化氢制取氢气,分析化学上硫化氢溶液用作离子分组试剂.
化石燃料开采和加工过程中常有硫化氢废气.工业上可用硫化氢制取氢气,分析化学上硫化氢溶液用作离子分组试剂.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 2007年诺贝尔化学奖授予德国科学家格哈德?埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献.
2007年诺贝尔化学奖授予德国科学家格哈德?埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.
科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 与
与
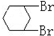 与
与
 与
与
 与
与
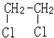 与CH3-CH2Cl
与CH3-CH2Cl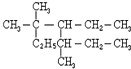 是某有机物结构简式,按系统命名法,该有机物的命名正确的是
是某有机物结构简式,按系统命名法,该有机物的命名正确的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com