
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验。请回答相关问题:

(1)定性分析:如上图甲可观察___________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___________________________。
(2)定量分析:如上图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为____________,实验中需要测量的数据是____________________
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当三个反应中转移的电子个数之比为9:3:8 时,在同温同压下三个反应中所制得氧气体积之比为( )
A.4:3:2 B.9:3:16 C.2:2:1 D.9:3:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链烃A是重要的有机化工原料,由A经以下反应可制备一种有机玻璃:
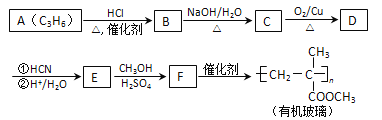
已知以下信息:
①核磁共振氢谱表明D只有一种化学环境的氢;
②羰基化合物可发生以下反应: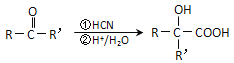 (注:R′可以是烃基,也可以是H原子)
(注:R′可以是烃基,也可以是H原子)
③E在甲醇、硫酸的作用下,发生酯化、脱水反应生成F。
回答下列问题:
(1)A的结构简式为_____,A生成B的反应类型为_______。
(2)B生成C的化学方程式为_______。
(3)D的结构简式为_____,分子中最多有 __________个原子共平面。
(4)F的化学名称为_______。
(5)F的同分异构体中能同时满足下列条件的共有 ______种(不含立体异构);其中核磁共振氢谱显示为4组峰,且峰面积比为3 : 2 : 2 : 1的是_____; (写出其中一种的结构简式)。
①能与饱和NaHCO3溶液反应产生气体 ②能使Br2的四氯化碳溶液褪色
(6)聚乳酸(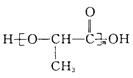 )是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 ___________ 。合成路线流程图图示例如下:
)是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 ___________ 。合成路线流程图图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁在潮湿的空气中会被腐蚀,发生的原电池反应:2Fe+2H2O+O2=2Fe2++4OH-。以下说法正确的是
A. 负极发生的反应为:Fe-2e-=Fe2+
B. 正极发生的反应为:2H2O+O2+2e-=4OH-
C. 原电池是将电能转变为化学能的装置
D. 钢柱在水下部分比在空气与水交界处更容易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质形成的晶体,化学键种类和作用方式完全相同的同类型晶体是
A. SO2与SiO2 B. CO2与H2O C. NaCl与Li2O D. CCl4与KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生活中,需要对化学反应的速率和化学反应的限度进行研究,以便控制化学反应。
I.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。
反应物 | 催化剂 | 温度 | |
① | 10mL10% H2O2溶液 | 无 | 25℃ |
② | 10mL20% H2O2溶液 | 无 | 25℃ |
③ | 10mL20% H2O2溶液 | 无 | 40℃ |
④ | 10mL20% H2O2溶液 | 1~2滴0.1mol/LFeCl3溶液 | 40℃ |
通过实验得到氧气的体积与时间的关系如图所示,回答下列问题:

(1)代表实验①的图示是________________。
(2)对比实验③和④的目的是_____________。
(3)通过上面对比实验,所得的实验结论是_______。
Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3 mol H2,一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),测得其中N2物质的量随时间变化如图所示。回答下列问题:
2NH3(g),测得其中N2物质的量随时间变化如图所示。回答下列问题:

(4)从开始反应到t2时刻,氨气的平均反应速率为_____________。
(5)在t3时刻,氢气的转化率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 是短周期界元素中的四种非金属元素,它们的原子序数依次增大,
是短周期界元素中的四种非金属元素,它们的原子序数依次增大,![]() 元素的原子形成的离子就是一个质子,
元素的原子形成的离子就是一个质子,![]() 、
、![]() 在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,
在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,![]() 原子的最外层电子数是内层电子数的2倍。
原子的最外层电子数是内层电子数的2倍。
1.请写出![]() 在元素周期表中的位置为第________周期、第________族。
在元素周期表中的位置为第________周期、第________族。
2.气体分子![]() 的电子式为________________
的电子式为________________
3.由![]() 、
、![]() 、
、![]() 、
、![]() 四种元素可组成酸式盐,该化合物的水溶液与足量
四种元素可组成酸式盐,该化合物的水溶液与足量![]() 溶液在加热条件下反应的离子方程式为_________________。
溶液在加热条件下反应的离子方程式为_________________。
4.在一定条件下,由![]() 单质与单质可化合生成
单质与单质可化合生成![]() ,工业上用
,工业上用![]() 检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质
检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质![]() 生成,写出化学方程式__________________________________。该反应中被氧化的
生成,写出化学方程式__________________________________。该反应中被氧化的![]() 与参与反应的
与参与反应的![]() 的质量之比____________。
的质量之比____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com