
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法不正确的是
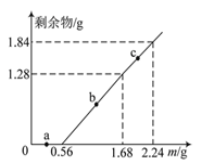
A. a点时溶液中阳离子为Cu2+、Fe2+和Fe3+
B. b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C. c点时溶液中溶质的物质的量浓度为0.5 mol·L-1
D. 原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
【答案】D
【解析】
向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,首先铁离子氧化单质铁,然后是铜离子氧化单质铁,结合反应的方程式和图像分析判断。
A、向100mLFe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,先发生反应:Fe+2Fe3+=3Fe2+,后发生反应:Fe+Cu2+=Cu+Fe2+,如图加入0.56g(即0.01mol)Fe之后开始出现固体,则a点溶液中阳离子为Cu2+、Fe2+和Fe3+,故A正确;
B、由图可得,加入铁粉从0.56g~1.68g(即0.01mol~0.03mol)时,剩余物为1.28g,而1.28gCu的物质的量为0.02mol,所以此时发生反应为:Fe+Cu2+=Cu+Fe2+,b点在该范围内,故B正确;
C、加入铁粉为从0.56g~2.24g(即0.01mol~0.04mol)时,若发生反应Fe+Cu2+=Cu+Fe2+,则生成0.03mol(即1.92g)Cu,而由图示可得剩余物为1.84g,所以此时溶液中早已没有Cu2+,设0.03mol铁粉中与Cu2+反应的为x mol,剩余y mol,则生成Cu的质量为64x g,剩余铁的质量为56y g,所以x+y=0.03、64x+56y=1.84,解得:x=0.02、y=0.01,因此加入铁粉从0.56g~1.68g(即0.01mol~0.03mol)时,刚好与溶液中的Cu2+反应完全,溶液中溶质为FeSO4,又根据前面的分析可得反应Fe+2Fe3+=3Fe2+生成Fe2+0.03mol,又因为反应Fe+Cu2+=Cu+Fe2+生成Fe2+0.02mol,所以c点时溶液中溶质的物质的量浓度为:(0.03mol+0.02mol)÷0.1L=0.5 mol·L-1,故C正确;
D、由前面的分析可得,原溶液中Fe3+为0.02mol,则Fe2(SO4)3为0.01mol,Cu2+为0.02mol,则CuSO4为0.02mol,所以原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比=物质的量之比,为1:2,故D错误。
答案选D。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质与沸水缓慢反应,且该单质可制造照明弹;f为固体单质。下列有关说法正确的是
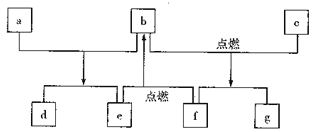
A. 简单离子的半径:Y>Z>X B. 元素的非金属性:W>X
C. 最高价氧化物对应水化物的碱性:Y>Z D. X、Y两种元素组成的化合物只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入CO和CO2的混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内压强为P1,若控制容器的体积不变,加入足量的过氧化钠,并不断用电火花点燃至完全反应,恢复到开始的温度,再次测得容器内的压强为P2,则P1和P2关系是
A. P1=8P2 B. P1=4P2 C. P1=2P2 D. P1=P2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙可以作为生氢剂(其中CaH2中氢元素为﹣1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是( )
A.既不是氧化剂也不是还原剂
B.是氧化剂
C.是还原剂
D.既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁发生析氢腐蚀时,正极上发生的电极反应是
A. 2H++2e-=H2↑ B. Fe2++2e-=Fe
C. 2H2O+O2+4e-=4OH- D. Fe3++e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.15mol/L,c(Cl﹣)=0.2mol/L,则c(NO3﹣)为( )
A.0.05 mol/L
B.0.20 mol/L
C.0.30 mol/L
D.0.40 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的恒温恒容密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L。则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L。则下列判断正确的是
A. c1:c2=1:2 B. 平衡时,Y和Z的生成速率之比为2:3
C. 若反应正向进行,X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:
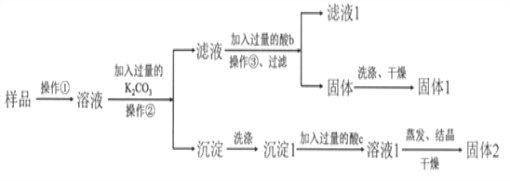
(1)试剂c的化学式是__________,固体1的化学式是__________。加入过量K2CO3所发生反应的化学方程式为________________________________。
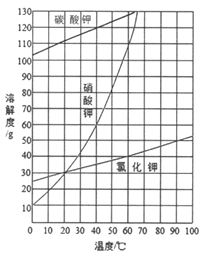
(2)结合下图各物质的溶解度曲线可知操作③的名称是_______、________。
(3)有同学认为操作③之前无需加入过量的酸b,也能得到纯净的固体1,你认为该同学的观点是否正确?_____;并做出相应解释___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com