
【题目】芳香族化合物A为无色黏稠液体。为研究A的组成与结构,进行了如下实验:
(1)称取A升温使其汽化,测其密度是相同条件下H2的69倍。实验结论:A的相对分子质量为___。
(2)将13.8gA在足量O2中充分燃烧,并使其产物依次缓缓通过足量浓硫酸、碱石灰,发现两者分别增重5.4g和30.8g。则A的分子式为___。
(3)A既能发生银镜反应,又能水解,若将13.8gA与足量金属钠反应则生成1.12LH2(标准状况)。则A中含有的官能团(名称):____。
(4)A的核磁共振氢谱峰的面积之比为1:2:2:1。实验结论:A的结构简式为____。
(5)与A互为同分异构体的芳香族化合物,还有____种。
【答案】138 C7H6O3 酯基、羟基 ![]() 11
11
【解析】
由题意可知,有机物质A的相对分子质量为138,0.1molA中含有0.7mol碳原子、0.6mol氢原子和0.3mol氧原子,A的分子式为C7H6O3,A既能发生银镜反应,又能水解,13.8gA与足量金属钠反应则生成1.12LH2(标准状况),说明A分子中含有1个甲酸酯基和1个酚羟基,由核磁共振氢谱峰的面积之比为1:2:2:1可知A的结构简式为![]() 。
。
(1)有机物质A的密度是相同条件下H2的69倍,则有机物质A的相对分子质量为69×2=138,故答案为:138;
(2)13.8gA的物质的量为![]() =0.1mol,浓硫酸增重5.4g,说明燃烧生成水的质量是5.4g,则有机物中氢原子的物质的量为
=0.1mol,浓硫酸增重5.4g,说明燃烧生成水的质量是5.4g,则有机物中氢原子的物质的量为![]() ×2=0.6mol,碱石灰增重30.8g,说明燃烧生成二氧化碳的质量为30.8g,则有机物中碳原子的物质的量为
×2=0.6mol,碱石灰增重30.8g,说明燃烧生成二氧化碳的质量为30.8g,则有机物中碳原子的物质的量为![]() =0.7mol,氧原子的物质的量为
=0.7mol,氧原子的物质的量为![]() =0.3mol,则n(A):n(C):n(H):n(O)=0.1:0.7:0.6:0.3=1:7:6:3,则A的分子式为C7H6O3,故答案为:C7H6O3;
=0.3mol,则n(A):n(C):n(H):n(O)=0.1:0.7:0.6:0.3=1:7:6:3,则A的分子式为C7H6O3,故答案为:C7H6O3;
(3)芳香族化合物A的分子式为C7H6O3,A既能发生银镜反应,又能水解,13.8gA与足量金属钠反应则生成1.12LH2(标准状况),说明A分子中含有1个甲酸酯基和1个酚羟基,故答案为:酯基、羟基;
(4)A的核磁共振氢谱峰的面积之比为1:2:2:1说明甲酸酯基和酚羟基在苯环上处于对位,则A的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)A的结构简式为![]() ,与A互为同分异构体的芳香族化合物可以含有1个甲酸酯基和1个酚羟基,除A外还有邻、对2种结构,可以是含有1个羧基和1个酚羟基,有邻、间、对3种结构,还可以是含有2个酚羟基和一个醛基,其中邻二酚被醛基取代的结构有2种、间二酚被醛基取代的结构有3种、对二酚被醛基取代的结构有1种,共11种,故答案为:11。
,与A互为同分异构体的芳香族化合物可以含有1个甲酸酯基和1个酚羟基,除A外还有邻、对2种结构,可以是含有1个羧基和1个酚羟基,有邻、间、对3种结构,还可以是含有2个酚羟基和一个醛基,其中邻二酚被醛基取代的结构有2种、间二酚被醛基取代的结构有3种、对二酚被醛基取代的结构有1种,共11种,故答案为:11。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】物质的结构决定性质。回答下列有关问题:
(1)BF3的空间构型为______。SO32-中心原子的杂化类型是______。
(2)H2S的沸点比H2O2的沸点______![]() 选填“高”或“低”
选填“高”或“低”![]() ;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
(3)从分子结构的角度分析“白磷不溶于水,易溶于CS2”的原因______。
(4)CuCl难溶于水但易溶于氨水,其原因是______;此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______。
(5)已知CaF2晶胞结构如图所示,晶体密度为![]() g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含
g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含![]() 、NA的代数式表达)
、NA的代数式表达)
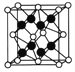
(6)一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,该晶体中原子之间的作用力是______;该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入NO2气体,发生反应2NO2(g)![]() N2O4(g):
N2O4(g):
(1)恒温恒压时,平衡后充入惰性气体,平衡___移动(填“正向”、“逆向”或“不”);
(2)平衡后慢慢压缩气体体积,平衡向右移动,混合气体颜色___(填“加深”、“变浅”或“不变”);
(3)若向体积为2L的恒容密闭容器中充入2molNO2,达到平衡状态时NO2转化率为a,向体积为2L的恒压密闭容器中充入2molNO2,达到平衡状态时NO2转化率为b,则a__b(填“>”、“<”或“=”);
(4)若向体积为2L的恒容密闭容器中充入2molNO2,达到平衡状态时NO2体积分数为a,再向该容器中继续充入1molN2O4,达到新平衡后NO2体积分数为b,则a__b(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
|
| ||||
相对分子质量 | 密度/(g/cm-3) | 沸点/℃ | 水中溶解性 | ||
异戊醇 | 88 | 0.8123 | 131 | 微溶 | |
乙酸 | 60 | 1.0492 | 118 | 溶 | |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 | |
实验步骤:在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)仪器B的名称是__。
(2)在洗涤操作中,第一次水洗的主要目的是__;第二次水洗的主要目的是__。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后___(填标号)。
A.直接将乙酸异戊酯从分液漏斗的上口倒出
B.直接将乙酸异戊酯从分液漏斗的下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是__。
(5)在蒸馏操作中,仪器试剂的选择及安装都正确的是__(填标号)。
A.  B.
B.
C. D.
D.
(6)本实验的产率是__。
(7)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏__(填“高”或“低”),其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色) ![]() 2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )
2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )
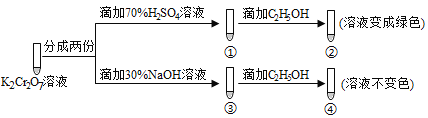
A. ①中溶液橙色加深,③中溶液变黄 B. ②中Cr2O72-被C2H5OH还原
C. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 D. 对比②和④可知K2Cr2O7酸性溶液氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.实验室将少量Na保存在乙醇中
B.可用激光笔鉴别FeCl3溶液和Fe(OH)3胶体
C.32 g O3中含有的氧原子数约是3×6.02×1023
D.常温下,可以用铝制容器来储运浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备Co2O3的工艺流程简图如下:
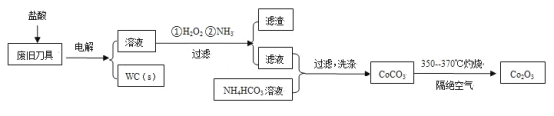
已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Co2+ |
开始沉淀的pH | 1.9 | 7.0 | 6.5 |
沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列问题:
(1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有:Co-2e-=Co2+和______。
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是_______。
(3)生成CoCO3的离子方程式是________。
(4)实验测得NH4HCO3溶液显碱性。制备CoCO3时,不能将滤液加入NH4HCO3溶液中,原因是_______。
(5)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若仅从沉淀转化角度考虑,在0.01mol/L Na2C2O4溶液中加入CoCO3固体能否转化为CoC2O4沉淀?通过计算说明:_________。
(6)洗涤CoCO3不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因是____。
(7)CoCO3生成Co2O3的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.![]() 与氢气完全反应后,生成2,2,
与氢气完全反应后,生成2,2,![]() 三甲基戊烷
三甲基戊烷
B.工业上由乙烯制乙醇、苯制环己烷均属于加成反应
C.![]() 的同分异构体共有3种
的同分异构体共有3种
D.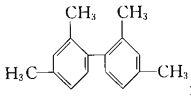 分子中所有碳原子一定在同一平面上
分子中所有碳原子一定在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com