
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
|
| ||||
相对分子质量 | 密度/(g/cm-3) | 沸点/℃ | 水中溶解性 | ||
异戊醇 | 88 | 0.8123 | 131 | 微溶 | |
乙酸 | 60 | 1.0492 | 118 | 溶 | |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 | |
实验步骤:在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)仪器B的名称是__。
(2)在洗涤操作中,第一次水洗的主要目的是__;第二次水洗的主要目的是__。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后___(填标号)。
A.直接将乙酸异戊酯从分液漏斗的上口倒出
B.直接将乙酸异戊酯从分液漏斗的下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是__。
(5)在蒸馏操作中,仪器试剂的选择及安装都正确的是__(填标号)。
A.  B.
B.
C. D.
D.
(6)本实验的产率是__。
(7)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏__(填“高”或“低”),其原因是__。
【答案】球形冷凝管 洗掉大部分硫酸和乙酸 洗掉碳酸氢钠 D 提高醇的转化率 D 60% 高 会收集少量未反应的异戊醇
【解析】
(1)由装置中仪器B的构造可知,仪器B的名称为球形冷凝管,起到冷凝回流作用, 故答案为:球形冷凝管;
(2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;第一步中饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,但第一步洗涤后生成的酯中混有碳酸氢钠,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠,故答案为:洗掉大部分硫酸和醋酸;洗掉碳酸氢钠;
(3)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为D故答案为:D;
(4)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动;增加一种反应物的浓度可以使另一种反应物的转化率提高,因此本实验中加入过量乙酸的目的是提高转化率,故答案为:提高异戊醇的转化率;
(5)加热液体混合物需要加沸石,防止暴沸,蒸馏时温度计测量馏分的温度,故温度计水银球与蒸馏烧瓶支管口处对齐,冷凝水下进上出,故装置图选择D;
(6)设4.4g的异戊醇,需要消耗mg的乙酸则
CH3COOH~C5H12O~乙酸异戊酯
60 ~88 ~ 130
m 4.4 x
![]() g,故乙酸过量;生成乙酸异戊酯的量要按照异戊醇的量计算,设4.4g的异戊醇完全反应会生成mg乙酸异戊酯则
g,故乙酸过量;生成乙酸异戊酯的量要按照异戊醇的量计算,设4.4g的异戊醇完全反应会生成mg乙酸异戊酯则
x= ![]() =6.5g,本实验的产率
=6.5g,本实验的产率![]() ×100%=60%, 故答案为:60%;
×100%=60%, 故答案为:60%;
(7)在进行蒸馏操作时,若从130°C便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,因此会导致产率偏高,故答案为:高;会收集少量未反应的异戊醇。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:
【题目】碘是合成碘化物的基本原料。空气吹出法从卤水中提碘的流程如下。

(1)“氧化”时若Cl2过量,则会将I2氧化为HIO3,写出该反应的化学方程式_____________。
(2)“吹出”在吹出塔中进行,含碘卤水从_______(填“塔顶”或“塔底”)进入, 请解释这样做的原因_______________________
(3)从“氧化”所得含碘卤水中提取碘还可以采用加CCl4的方法,该分离方法为_______;为进一步分离I2和CCl4,向其中加入NaOH溶液与I2反应,生成的I-、IO![]() 进入水溶液;分液后再酸化,即得粗碘。加入NaOH后溶液中I-、IO
进入水溶液;分液后再酸化,即得粗碘。加入NaOH后溶液中I-、IO![]() 的物质的量之比为_______。
的物质的量之比为_______。
(4)H2O2也能发生与Cl2类似的反应,若先用H2O2将卤水中的I-氧化为 IO![]() ,再将其与卤水按一定比例混合、酸化制取粗碘。处理含I-为254 mg/L的卤水1m3,理论上需20%的H2O2______g。
,再将其与卤水按一定比例混合、酸化制取粗碘。处理含I-为254 mg/L的卤水1m3,理论上需20%的H2O2______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为__________________。
(4)Z与R能形成化合物甲,1 mol甲中含________ mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为_________________________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为___________________。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1 539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应过程中的离子方程式
为________________________;________________________。
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子;
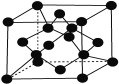
若X晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则该晶胞的体积为________ cm3 (用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如图,下列说法正确的是( )
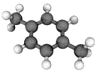
A.“PX”属于脂环烃
B.“PX”的二氯代物共有7种(不考虑立体异构)
C.“PX”分子中,最多有12个原子共面
D.“PX”的同系物均可使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
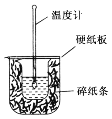
(1)从实验装置上看,图中尚缺少一种玻璃仪器是___。
(2)实验中改用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热___(填“相等”、“偏小”或“偏大”)。
(3)若测得该反应的中和热为57.3kJ/mol,请写出表示中和热的热化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】EPR橡胶(![]() )和PC塑料(
)和PC塑料( )的合成路线如图:
)的合成路线如图:

(1)A的名称是___。
(2)C的结构简式____。
(3)下列说法不正确的是(选填字母)____。
A.反应Ⅱ的原子利用率为100%
B.反应Ⅲ为取代反应
C.1molE与足量金属Na反应,最多可生成标准状况下22.4LH2
D.CH3OH在合成PC塑料的过程中可以循环利用
(4)反应II的化学方程式是___。
(5)反应Ⅳ的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A为无色黏稠液体。为研究A的组成与结构,进行了如下实验:
(1)称取A升温使其汽化,测其密度是相同条件下H2的69倍。实验结论:A的相对分子质量为___。
(2)将13.8gA在足量O2中充分燃烧,并使其产物依次缓缓通过足量浓硫酸、碱石灰,发现两者分别增重5.4g和30.8g。则A的分子式为___。
(3)A既能发生银镜反应,又能水解,若将13.8gA与足量金属钠反应则生成1.12LH2(标准状况)。则A中含有的官能团(名称):____。
(4)A的核磁共振氢谱峰的面积之比为1:2:2:1。实验结论:A的结构简式为____。
(5)与A互为同分异构体的芳香族化合物,还有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列五种物质:
A. O2和O3
B.![]() 和
和![]()
C.CH3COOCH2CH3和CH3COOCH3
D.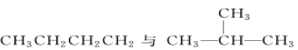
E. 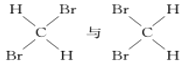
①________组两种物质互为同位素; ②________组两种物质互为同素异形体;
③________组两种物质互为同系物; ④________组两种物质互为同分异构体;
⑤________组两种物质为同一种物质;
(2)现有六种有机物:
A. CH3OH B.(CH3)3CCH2OH C.(CH3)3COH
D. (CH3)2CHOH E. C6H5CH2OH F. (CH3)2CHCl
①能被氧化铜氧化生成醛的有________。
②能被氧化铜氧化成酮的有________。
③能发生消去反应生成烯烃的有________。
(3)现有四种有机物:
A. (CH3)2CHCl B. CH3COOCH C. OHCCH2COOH D. CH3COOCH3
①能与新制Cu(OH)2反应的有________。
②能与NaOH水溶液反应的有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着石油资源的日益枯竭,天然气的廾发利用越来越受到重视。CH4/CO2催化重整制备合成气(CO和H2)是温室气体CO2和CH4资源化利用的重要途径之一,并受了国内外研究人员的高度重视。回答下列问题:
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CH4/CO2催化重整反应为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
该催化重整反应的△H=______kJ·mol-1。要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为_____。
(2)向2L刚性密闭容器中充入2molCH4和2mol CO2进行催化重整反应,不同温度下平衡体系中CH4和CO的体积分数(![]() )随温度变化如下表所示。
)随温度变化如下表所示。
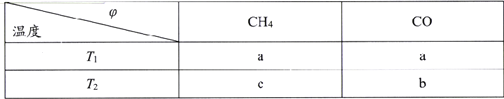
已知b>a>c,则T1______T2(填“>”“<”或“=”)。T1下该反应的平衡常数K=_______(mol2·L-2)
(3)实验硏究表明,载体对催化剂性能起着极为重要的作用,在压强0.03MPa,温度750℃条件下,载体对镍基催化剂性能的影响相关数据如下表:

由上表判断,应选择载体为_______(填化学式),理由是________。
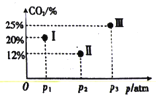
(4)现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均充入2mol CH4(g)和2 molCO2(g)进行反应,三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的情况下,反应均进行到tmin时,CO2的体积分数如图所示,此时I、Ⅱ、Ⅲ个容器中一定处于化学平衡状态的是_______。
(5)利用合成气为原料合成甲醇,其反应为CO(g)+2H2(g)![]() CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
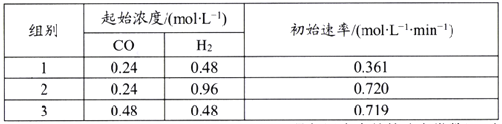
该反应速率的通式为ν正=k正cm(CO)·cn(H2)(k正是与温度有关的速率常数)。由表中数据可确定反应速率的通式中n=____(取正整数)。若该温度下平衡时组别1的产率为25%,则组别1平衡时的v正=______(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com