
【题目】EPR橡胶(![]() )和PC塑料(
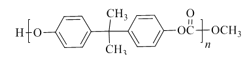
)和PC塑料( )的合成路线如图:
)的合成路线如图:

(1)A的名称是___。
(2)C的结构简式____。
(3)下列说法不正确的是(选填字母)____。
A.反应Ⅱ的原子利用率为100%
B.反应Ⅲ为取代反应
C.1molE与足量金属Na反应,最多可生成标准状况下22.4LH2
D.CH3OH在合成PC塑料的过程中可以循环利用
(4)反应II的化学方程式是___。
(5)反应Ⅳ的化学方程式是___。
【答案】丙烯 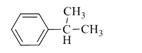 B 2CH2=CH2+O2
B 2CH2=CH2+O2![]() 2
2![]() n
n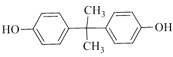 +n
+n![]()
 +(2n-1)CH3OH
+(2n-1)CH3OH
【解析】
EPR橡胶(![]() )的单体为CH2=CH2和CH2=CHCH3,EPR由A、B反应得到,B发生氧化反应生成环氧己烷,则B为CH2=CH2、A为CH2=CHCH3;结合PC和碳酸二甲酯的结构可知,C15H16O2为
)的单体为CH2=CH2和CH2=CHCH3,EPR由A、B反应得到,B发生氧化反应生成环氧己烷,则B为CH2=CH2、A为CH2=CHCH3;结合PC和碳酸二甲酯的结构可知,C15H16O2为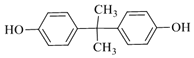 ;D与丙酮反应得到C15H16O2,结合D的分子式,可推知D为
;D与丙酮反应得到C15H16O2,结合D的分子式,可推知D为![]() ;结合C的分子式可知,A和苯发生加成反应生成C,再结合C的氧化产物可推知C为
;结合C的分子式可知,A和苯发生加成反应生成C,再结合C的氧化产物可推知C为![]() ;由
;由![]() 与甲醇反应生成E与碳酸二甲酯的反应为取代反应可推知E为HOCH2CH2OH。
与甲醇反应生成E与碳酸二甲酯的反应为取代反应可推知E为HOCH2CH2OH。
(1)根据分析可知,A为的结构简式为CH2=CHCH3,名称为丙烯,故答案为:丙烯;
(2)C的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(3) A.反应Ⅱ为银做催化剂作用下,乙烯与氧气反应生成环氧乙烷,原子利用率为100%,故正确;
B.反应Ⅲ为环氧乙烷与二氧化碳发生加成反应生成![]() ,故错误;
,故错误;
C.E的结构简式为HOCH2CH2OH,1molE与足量金属Na反应,最多可以生成1mol氢气,标准状况下,1mol氢气的体积为22.4L,故正确;
D.由分析可知,生成PC的同时生成甲醇,生成E时需要甲醇,所以CH3OH在合成PC塑料的过程中可以循环利用,故正确;
B错误,故答案为B;
(4) 反应II为银做催化剂作用下,乙烯与氧气反应生成环氧乙烷,反应的化学方程式是2CH2=CH2+O2![]() 2
2![]() ,故答案为:2CH2=CH2+O2
,故答案为:2CH2=CH2+O2![]() 2
2![]() ;
;
(5)反应Ⅳ为催化剂作用下, 与
与![]() 发生缩聚反应生成
发生缩聚反应生成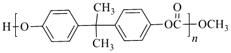 ,反应的化学方程式是n
,反应的化学方程式是n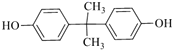 +n
+n![]()
![]()
 +(2n-1)CH3OH,故答案为:n
+(2n-1)CH3OH,故答案为:n +n
+n![]()
![]()
 +(2n-1) CH3OH。
+(2n-1) CH3OH。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】某高分子材料的结构简式如图所示:已知该高分子材料是由三种单体聚合而成的,下列与该高分子材料相关的说法正确的是( )
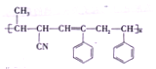
A. 该高分子材料是体型高分子,合成它的反应是加聚反应
B. 形成该高分子材料的单体![]() 中,所有原子可能处于同一平面内
中,所有原子可能处于同一平面内
C. 三种单体中有两种有机物互为同系物
D. 三种单体都可以使溴水褪色,但只有两种能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:

下列说法错误的是( )
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-= SO32-+H2O
C. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
D. 进入离心机的分散系是悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过_____方法区分晶体、准晶体和非晶体。
(2)基态铜原子价电子排布的轨道式为______。
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______、______
(4)NH4F(氟化铵)可用于玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是;氟化铵中存在______(填序号):
A.离子键B.σ键C.π键D.氢键
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系关键能。则F-F键的键能为kJmol-1,S-F的键能为______kJmol-1。
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF比CuCl熔点高的原因是______;
②已知NA为阿伏加德罗常数。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=___nm(列出计算式)。
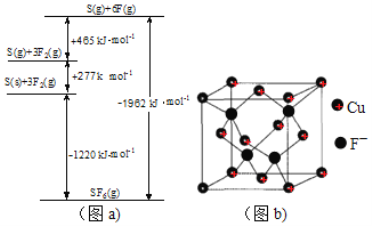
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
|
| ||||
相对分子质量 | 密度/(g/cm-3) | 沸点/℃ | 水中溶解性 | ||
异戊醇 | 88 | 0.8123 | 131 | 微溶 | |
乙酸 | 60 | 1.0492 | 118 | 溶 | |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 | |
实验步骤:在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)仪器B的名称是__。
(2)在洗涤操作中,第一次水洗的主要目的是__;第二次水洗的主要目的是__。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后___(填标号)。
A.直接将乙酸异戊酯从分液漏斗的上口倒出
B.直接将乙酸异戊酯从分液漏斗的下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是__。
(5)在蒸馏操作中,仪器试剂的选择及安装都正确的是__(填标号)。
A.  B.
B.
C. D.
D.
(6)本实验的产率是__。
(7)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏__(填“高”或“低”),其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到2020年我国单位国内生产总值二氧化碳排放比2005年下降40%~45%,作为约束性指标纳入国民经济和社会发展的中长期规划,将![]() 转化成有机物可有效实现碳循环。
转化成有机物可有效实现碳循环。![]() 转化成有机物的例子很多,如
转化成有机物的例子很多,如
①![]()
②![]()
③![]()
④![]()
对以上反应,下列说法正确的是( )
A.最节能的是反应①
B.因为![]() 有毒,故反应②无应用价值
有毒,故反应②无应用价值
C.反应③的原子利用率为100%
D.反应④是工业生产乙烯的主要方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
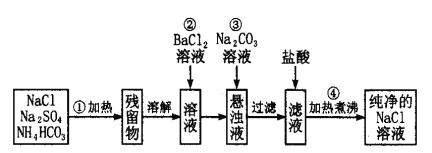
请回答下列问题:
(1)操作①可在什么仪器中进行?(填序号)__________。
A. 烧瓶 B. 坩埚 C. 容量瓶
(2)操作②发生的离子反应方程式为______________________________。
(3)操作②是否可改为加硝酸钡溶液?为什么?______________________。
(4)进行操作②后,如何判断SO42-已除尽,方法是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末,可能由碳酸钠、碳酸钙、硫酸铜、硝酸钾和硝酸钡中的一种或几种组成,为确定其组成,进行如下实验:
![]() 称取15.9g该白色粉末加足量水溶解,得无色澄清溶液;
称取15.9g该白色粉末加足量水溶解,得无色澄清溶液;
![]() 在无色溶液中加入过量氢氧化钙溶液,充分反应后过滤,分别得无色溶液和白色沉淀;将白色沉淀洗涤、烘干后称得质量为15.9g。
在无色溶液中加入过量氢氧化钙溶液,充分反应后过滤,分别得无色溶液和白色沉淀;将白色沉淀洗涤、烘干后称得质量为15.9g。
由上述实验得出的下列判断中,正确的是
A.白色粉末中肯定含有硝酸钾,肯定没有硫酸铜,可能含有硝酸钡
B.白色粉末中肯定含有硝酸钾,肯定没有碳酸钙,可能含有碳酸钠
C.白色粉末中不含碳酸钠和硝酸钡,只含有硝酸钾
D.白色粉末中不含硝酸钡和硝酸钾,只含有碳酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com