
【题目】废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备Co2O3的工艺流程简图如下:
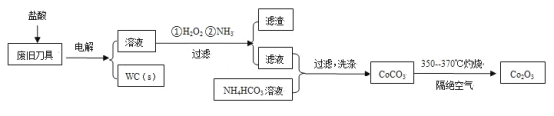
已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Co2+ |
开始沉淀的pH | 1.9 | 7.0 | 6.5 |
沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列问题:
(1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有:Co-2e-=Co2+和______。
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是_______。
(3)生成CoCO3的离子方程式是________。
(4)实验测得NH4HCO3溶液显碱性。制备CoCO3时,不能将滤液加入NH4HCO3溶液中,原因是_______。
(5)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若仅从沉淀转化角度考虑,在0.01mol/L Na2C2O4溶液中加入CoCO3固体能否转化为CoC2O4沉淀?通过计算说明:_________。
(6)洗涤CoCO3不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因是____。
(7)CoCO3生成Co2O3的化学方程式是_________。
【答案】Fe -2e-=Fe2+ 3.2≤pH<6.5 Co2+ +2HCO3-=CoCO3↓+CO2↑+H2O 将滤液加入显碱性的NH4HCO3溶液中会生成Co(OH)2杂质 ![]()
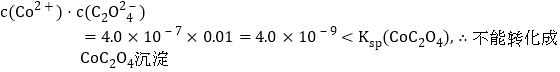 灼烧时,CoCO3中残留的NH4Cl分解产生NH3和HCl 2CoCO3
灼烧时,CoCO3中残留的NH4Cl分解产生NH3和HCl 2CoCO3![]() Co2O3+CO2↑+CO↑
Co2O3+CO2↑+CO↑
【解析】
由题给工艺流程知,以盐酸为电解质溶液,以废旧刀具作阳极,不锈钢作阴极,进行电解,生成WC,溶液中含有亚铁离子和Co2+,加入双氧水,将亚铁离子氧化为铁离子,通入氨气,调节pH在3.2到5.8之间,将铁离子转化为氢氧化铁沉淀过滤除去,滤液中含有Co2+,加入碳酸氢铵溶液生成碳酸钴,焙烧生成Co2O3,据此分析作答。
(l)依据电解原理可知,电解时废旧刀具作阳极,除了Co还有活泼金属铁也会失电子发生氧化反应;
(2)通入氨气的目的是调节溶液的pH,为了使铁元素完全沉淀,同时不让钴元素沉淀下来,根据表格数据作答;
(3)将NH4HCO3溶液缓慢加入到盛有滤液的反应容器中生成CoCO3;
(4)NH4HCO3溶液显碱性,据此分析作答;
(5)依据Ksp(CoCO3)=1.4×10-13计算出理论上开始沉淀时Co2+的物质的量浓度,再结合溶液中的C2O42-的物质的量浓度,根据离子积与Ksp(CoC2O4)的大小关系进行比较,得出结论。
(6)实验中获得的若洗涤不充分会含有氯化铵杂质,在焙烧时氯化铵受热易分解;
(7)依据氧化还原反应的规律可知,CoCO3隔绝空气灼烧生成Co2O3的同时,C元素化合价会降低,据此分析作答。
(1)电解时废旧刀具作阳极,不锈钢作阴极,盐酸的作用是作电解质溶液,依据阳极活泼金属放电的规律可知,除了Co失电子以外还有Fe也会失电子发生氧化反应,其电极反应式为:Fe -2e- = Fe2+;
故答案为:Fe -2e- = Fe2+;
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择pH最大范围是3.2pH<6.5;
故答案为:3.2pH<6.5;
(3)将NH4HCO3溶液缓慢加入到盛有滤液的反应容器中,生成CoCO3的离子方程式为:Co2+ +2HCO3-=CoCO3↓+CO2↑+H2O;
故答案为:Co2+ +2HCO3-=CoCO3↓+CO2↑+H2O;
(4) 根据题意可知,NH4HCO3溶液显碱性,则若将滤液加入该溶液中会反应生成Co(OH)2杂质,
故答案为:将滤液加入显碱性的NH4HCO3溶液中会生成Co(OH)2杂质;
(5)![]()
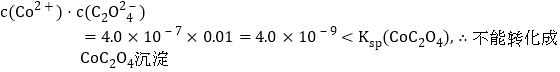 ,
,
故答案为:![]()
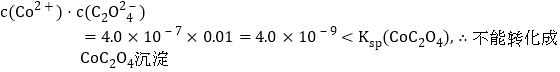 ;
;
(6)分析可知实验中获得的若洗涤不充分会含有氯化铵杂质,在焙烧时氯化铵分解会产生污染性气体HCl和NH3;
故答案为:灼烧时,CoCO3中残留的NH4Cl分解产生NH3和HCl;
(7)CoCO3生成Co2O3的同时,还会有二氧化碳与一氧化碳生成,其化学方程式为:2CoCO3![]() Co2O3+CO2↑+CO↑,
Co2O3+CO2↑+CO↑,
故答案为:2CoCO3![]() Co2O3+CO2↑+CO↑。
Co2O3+CO2↑+CO↑。


科目:高中化学 来源: 题型:
【题目】(1)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图所示:

①____极(填a或b)为电池的正极,电池工作时电子的流向为_______(填a→b或b→a)
②写出该电池负极的电极反应式________________________________________
(2)图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。

①Y中总反应的化学方程式为_____________________,滤纸上c点附近会变________色。
②电解一段时间后,Z产生280 mL的气体(标准状况下),此时溶液的体积为500 mL,假设溶液中还有AgNO3存在,则Z中溶液的pH是________,需加入________g的________可使溶液复原。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCN、CN在溶液中存在下列平衡,对应的平衡常数分别为K1和K2.①HCNH++CN△H1>0 K1 ②CN+H2OHCN+OH△H2>0 K2,常温下(K1=6.2×1010),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述不正确的是( )
A. K2≈1.6×103 B. 2c(Na+)=c(HCN)+c(CN-)
C. 混合溶液的pH>7 D. 对混合溶液升温, K1增大、K2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两位同学设计实验确定某酸HA是弱电解质,实验方案如下:

甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入浓度均为0.1 mol·L-1 的HA溶液、稀盐酸各10 mL,按图装好,观察现象。
乙:方案一:用pH计测定浓度为 0.1 mol·L-1HA溶液的pH;
方案二:取pH=3的HA溶液5 mL稀释至500 mL,再用pH计测其pH。
回答下列问题:
(1)甲同学设计的方案中,说明HA是弱电解质的实验现象是___________ (填序号)。
A. 加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
B. 加入HA溶液后,试管上方的气球鼓起慢
C. 加入稀盐酸后,试管上方的气球鼓起慢
(2)乙同学设计的方案一中说明HA是弱电解质的理由是:__________________
(3)乙同学设计的方案二中说明HA是弱电解质的pH的范围为__________________
(4)丙同学为了进一步证明外界条件对弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在 0.1mol·L-1 的HA溶液中,选择加入____________试剂;
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在 0.1mol·L-1 的HA溶液中,选择加入_____________试剂。
(5)若从盐类水解原理角度设计一个合理而比较容易进行的方案(药品可任取) ,证明HA是弱电解质,你的设计方案是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解的离子方程式中书写正确的是
A. S2-+ H2O = HS-+OH- B. CH3COO- + H2O![]() CH3COOH + OH-
CH3COOH + OH-
C. Al3++ H2O =Al(OH)3 D. CO32-+ 2H2O![]() H2CO3+ 2OH-
H2CO3+ 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类文明进步的阶梯,第ⅢA、ⅣA、VA及Ⅷ族元素是组成特殊材料的重要元素。
回答下列问题:
(1)基态B核外电子占据的最高能级的电子云轮廓图形状为________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为______。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的价层电子排布式为_____。
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型有__。
(4)MgCO3的热分解温度_____(填“高于”或“低于”)CaCO3的原因是________。
(5)NH3分子在独立存在时H-N-H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释NH3形成如图配合物后H-N-H键角变大的原因:_________。
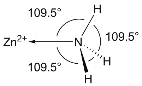
(6)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为_____,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为_____(用最简整数比表示)。假设晶胞边长为anm,NA代表阿伏伽德罗常数的值,则该晶胞的密度为_____g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO45H2O(s)═CuSO4(s)+5H2O(l)△H=+Q2kJmol-1则Q1、Q2的关系为
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①标准状况下,6. 02×1023个分子所占的体积约是22. 4 L
②0. 5 mol H2所占体积为11. 2 L
③标准状况下,1 mol H2 O的体积为22.4 L
④标准状况下,28 g CO与N2的混 合气体的体积约为22. 4 L
⑤各种气体的气体摩尔体积都 约为22. 4 L/mol
⑥标准状况下,体积相同的气体的分子数相同
A.①③⑤B.④⑥C.③④⑥D.①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:四甲基氢氧化铵[(CH3)4NOH ]是强碱,甲胺 (CH3NH2H2O)为弱碱。常温下,在体积均为20 mL、浓度均为0.1 mol/L的四甲基氢氧化铵溶液和甲胺溶液中,分别滴加浓度为0.1 mol/L的盐酸,溶液的导电率与盐酸体积的关系如图所示。下列说法正确的是

A. pH的相对大小: c>d
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b 点溶液:c(H+)+c(CH3NH3+) = c(OH-)
D. c 点溶液:c(Cl-)>c(CH3NH3+) >c(H+) >c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com