
【题目】下列水解的离子方程式中书写正确的是
A. S2-+ H2O = HS-+OH- B. CH3COO- + H2O![]() CH3COOH + OH-
CH3COOH + OH-
C. Al3++ H2O =Al(OH)3 D. CO32-+ 2H2O![]() H2CO3+ 2OH-
H2CO3+ 2OH-
【答案】B
【解析】
A.S2-属于弱酸根离子,能够发生水解,且水解过程微弱,属于可逆过程,且以第一步为主,正确的水解方程式为S2-+H2O![]() HS-+OH-,A错误;
HS-+OH-,A错误;
B.CH3COO-属于弱酸根离子,能够发生水解,且水解过程微弱,属于可逆过程,正确的水解方程式为CH3COO- +H2O![]() CH3COOH +OH-,B正确;
CH3COOH +OH-,B正确;
C.Al3+属于弱碱阳离子,能够水解,且水解过程微弱,属于可逆过程,水解生成氢氧化铝和氢离子,正确的水解方程式为Al3++ 3H2O![]() Al(OH)3 +3H+ ,C错误;
Al(OH)3 +3H+ ,C错误;
D.CO32-属于弱酸根离子,能够发生水解,且水解过程微弱,属于可逆过程,且分步水解,正确的水解方程式为CO32-+ H2O![]() HCO3-+ OH-,HCO3-+ H2O
HCO3-+ OH-,HCO3-+ H2O![]() H2CO3+ OH-,D错误;
H2CO3+ OH-,D错误;
综上所述,本题选B。


科目:高中化学 来源: 题型:
【题目】已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH与离子浓度的变化关系如图所示。下列叙述错误的是

A. BOH属于弱碱
B. BOH的电离常数K=1×10-4.8
C. P点所示的溶液中:c(Cl-)>c(B+)
D. N点所示的溶液中:c(H+)=c(Cl-)+c(OH-)-c(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.3g3He含的中子数为2NA
B.28g乙烯(C2H4)和环丁烷(C4H8)的混合气体所含碳原子数为2NA
C.标准状况下22.4LCl2与NaOH溶液完全反应,转移的电子数为2NA
D.1L0.4mol/L盐酸与0.1molMnO2共热后,生成Cl2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的________________。
(2)氯化铝溶液具有净水的作用,原因是(用离子方程式表示):_______________。
(3)已知CO (g) + H2O (g) ![]() CO2 (g) + H2 (g),在800℃时,该反应的化学平衡常数K=1.0,某时刻在一密闭容器中含1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,则上述条件下此反应v正________v逆(填“>”“<”或“=”)。
CO2 (g) + H2 (g),在800℃时,该反应的化学平衡常数K=1.0,某时刻在一密闭容器中含1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,则上述条件下此反应v正________v逆(填“>”“<”或“=”)。
(4)将25℃下pH=12的NaOH溶液a L与pH=1的HCl溶液b L混合。若所得混合液为中性,则a:b=_____________________。
(5)写出0.1mol/LNaOH溶液1L与标准状况下1.12LCO2完全反应后所得的溶液中各种离子浓度由大到小的顺序为____________________________。
(6)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为________________。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗标准状况下的CO 的体积为224 mL,则溶液的pH = ___________ 。(不考虑溶液体积的变化)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生按照课本实验要求,用50 mL 0.5 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量计算中和热。下列说法正确的是

A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯内填满碎纸条的作用是固定小烧杯
D. 酸或碱的物质的量越大,所测中和热的数值越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备Co2O3的工艺流程简图如下:
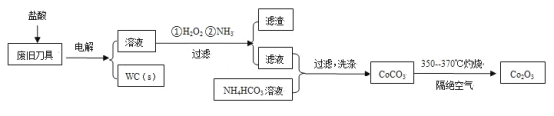
已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Co2+ |
开始沉淀的pH | 1.9 | 7.0 | 6.5 |
沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列问题:
(1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有:Co-2e-=Co2+和______。
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是_______。
(3)生成CoCO3的离子方程式是________。
(4)实验测得NH4HCO3溶液显碱性。制备CoCO3时,不能将滤液加入NH4HCO3溶液中,原因是_______。
(5)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若仅从沉淀转化角度考虑,在0.01mol/L Na2C2O4溶液中加入CoCO3固体能否转化为CoC2O4沉淀?通过计算说明:_________。
(6)洗涤CoCO3不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因是____。
(7)CoCO3生成Co2O3的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与盐类水解有关且正确的是: ( )
A. AlCl3溶液和NaAlO2溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C. 用加热的方法可除去KCl溶液中混有的Fe3+
D. 食醋可以溶解水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏伽德罗常数的值,则下列说法正确的是
A. 标准状况下,2.24L N2和O2的混合气体中分子数为0.1NA
B. 32g S8(分子结构: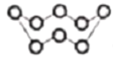 )中的共价键数目为8NA
)中的共价键数目为8NA
C. 3mol SO2和1mol O2于密闭容器中催化反应后分子总数为3NA
D. pH=1的H3BO3溶液中,含有H+的总数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热的表述正确的是
A. 当ΔH为“-”时,表示该反应为吸热反应
B. 已知C(s)+![]() O2(g)====CO(g)的反应热为110.5 kJ/ mol,说明碳的燃烧热为110.5 kJ / mol
O2(g)====CO(g)的反应热为110.5 kJ/ mol,说明碳的燃烧热为110.5 kJ / mol
C. 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D. 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,放出的热量:CH3COOH<HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com